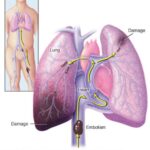
Тромбоэмболия лёгочной артерии (ТЭЛА) — заболевание с высокой летальностью, что обусловлено в числе прочего многообразием симптоматики. Полиморфизм клинической картины ТЭЛА приводит к частым ошибкам в диагностике. Ситуация осложняется и тем, что с данной патологией может столкнуться врач любой специальности: терапевт, гинеколог, хирург, травматолог, онколог, что подчёркивает важность детального изучения принципов диагностики и лечения ТЭЛА практическими врачами. Однако несмотря на многообразие клинических симптомов манифестации ТЭЛА, доминирующим симптомокомплексом является одышка. В связи с жалобами респираторного характера пациенты чаще всего сначала обращаются к терапевту.
Представлен клинический случай рецидивирующей тромбоэмболии лёгочной артерии у молодого пациента с наследственной тромбофилией. Рассмотрены особенности клинической симптоматики ТЭЛА и сложности диагностического пути в терапевтической практике. Проанализированы причины поздней диагностики ТЭЛА.
Пациент А. 1992 года рождения 14.10.2014 поступил в ГКБ № 14 г. Екатеринбурга в тяжёлом состоянии.
Жалобы
Молодой человек жаловался на одышку смешанного характера в покое, сухой кашель и общую слабость.
Впервые пациент отметил появление сухого кашля и одышки смешанного характера при занятии горнолыжным спортом.
Анамнез
Симптомы заболевания появились в апреле 2014 года во время спортивных нагрузок. Связав симптомы с охлаждением, пациент обратился к терапевту по месту жительства. Без дополнительных обследований был установлен диагноз ОРИ, пациент получал лечение нестероидными противовоспалительными препаратами (НПВС) без значительного эффекта.
При повторном обращении к терапевту в связи с кашлем и одышкой через месяц был установлен диагноз «бронхиальная астма«, назначено лечение ингаляционными бронходилятаторами (Форадил, Вентолин по требованию) амбулаторно. Спирометрия (исследование функции внешнего дыхания) в тот период не проводилась, диагноз был установлен клинически.
В течение следующих двух месяцев на фоне лечения нарастала одышка, кашель сохранялся. Пациент самостоятельно прекратил применение ингаляционных препаратов из-за отсутствия положительного эффекта. В этот период начал испытывать ограничения в физических нагрузках прежней интенсивности, однако за медицинской помощью не обращался.
27.08.2014 пациент обратился в частный медицинский центр в связи с усилением интенсивности вышеуказанных жалоб, значимым снижением толерантности к физической нагрузке (ТФН). Проведено исследование функции внешнего дыхания, выявлена умеренная обструкция бронхов:
- объём форсированного выдоха за первую секунду 76 % (норма — более 85 %);
- индекс Тиффно — индекс наличия или отсутствия нарушений бронхиальной проходимости — 80 % (норма).
При проведении пробы с бронхолитиком значимой динамики не получено. По результатам посева мокроты (27.08.14) обнаружен обильный рост условно-патогенных микроорганизмов Neisseria subflava, Streptococcus viridans и умеренный рост Serratia marcescens.
По результатам обследования установлен диагноз «хронический обструктивный бронхит этиологии Serratia marcescens”. Назначено:
- антибактериальная терапия цефалоспорином перорально;
- ингаляции фиксированной комбинацией ингаляционного кортикостероида (иГКС) и бета-агониста продлённого действия (БАПД) симбикорт 160/4,5 мкг;
- бронхолитик короткого действия Беродуал 2 раза в день.
Однако проведённая терапия не имела значимого эффекта.
В течение августа-сентября 2014 года пациент отметил критическое снижение ТФН: возникновение одышки при минимальной физической нагрузке и значительную общую слабость.
В октябре 2014 года пациент вновь обратился к участковому терапевту, где был установлен диагноз «Вегето-сосудистая дистония по гипертензивному типу. Бронхиальная астма лёгкого течения, обострение». Рекомендовано продолжить приём иГКС и БАПД, к лечению добавлен приём бета-адреноблокаторов. Впервые с момента первичного обращения пациенту было назначено проведение электрокардиографии (ЭКГ) и эхокардиографии (ЭХОКГ) в плановом порядке.
10.10.14 при проведении ЭХОКГ было выявлено:
- увеличение размера правого желудочка до 37 мм.;
- трикуспидальная регургитация (обратное движение крови из правого желудочка в правое предсердие) III степени;
- систолическое давление в правом желудочке 103 мм рт ст. при норме 25 мм рт. ст.;
- объём, систолическая и диастолическая функции левого желудочка не были нарушены;
- фракция выброса (объём крови, выталкиваемой левым желудочком в момент его сокращения в просвет аорты) 71 %, что является нормой.
После получения данных результатов пациент направлен участковым терапевтом в стационар.
Хронических заболеваний пациент не отмечал. Туберкулёз, вирусные гепатиты не переносил. Операции не переносил. Получал травмы:
- 1999 г. — вывих правого локтевого сустава;
- 2001 г. — перелом правого лучезапястного сустава;
- 2003 г. — разрыв передней крестообразной связки правого коленного сустава;
- 2012 г. — перелом проксимальной фланги I пальца правой кисти.
Обследование
При физикальном исследовании выявлено:
- Общее состояние удовлетворительное,
- Тахипноэ (учащённое поверхностное дыхание) до 24 в минуту и тахикардия в покое до 97 ударов в минуту.
- Артериальное давление 110/70 мм рт.ст.
- Дыхание везикулярное (норма), хрипов нет.
- Тоны сердца приглушены. Акцент второго тона над лёгочной артерий. Второй тон образуется во время расслабления сердца после короткой паузы.
- Живот мягкий, безболезненный. Симптом Пастернацкого отрицателен симметрично, то есть при лёгком поколачивании в поясничной области пациент не чувствует боли. Положительный симптом Пастернацкого является признаком болезни почек.
В стационаре проведена компьютерная томография органов грудной клетки с контрастированием лёгочной артерии и её ветвей для исключения ТЭЛА.
- Выявлен участок снижения пневматизации (воздушности) в прикорневой зоне правого лёгкого по типу матового стекла, чётко ограниченный от нормальной ткани междольковым интерстицием (промежутком). Размер участка 44 х 20 х 24 мм.
- В 1 и 2 сегментах левого лёгкого и во 2 сегменте правого лёгкого — участки снижения пневматизации ткани по типу матового стекла большего диаметра, но меньшей интенсивности.
- В просвете ветвей лёгочной артерии — множественные пристеночные и обтурирующие (которые закупоривают ветви артерии) дефекты контрастирования.
- Справа дефекты в сегментарных артериях 1, 2, 3, 4 и 8 сегментов, а также в субсегментарных артериях 10 сегмента, обтурация (закупорка) субсегментарных артерий 10 сегмента.
- Слева дефекты в сегментарных артериях 1, 2, 3, 6, 9 и 10 сегментов
У пациента выявлен повышенный уровень D-димера (показателя тромбообразования): 1865 нг/мл (норма — до 500 нг/мл).
При компрессионной ультрасонографии вен нижних конечностей данных за тромбоз поверхностных и глубоких вен не получено.
14.10.14 ЭКГ пациента:
- Синусовый ритм с частотой сердечных сокращений (ЧСС) 100 в минуту.
- Отклонение электрической оси сердца вправо (один из критериев патологии сердца).
- Признаки перегрузки правого желудочка.
Диагноз
- Внегоспитальная двухсторонняя инфарктная пневмония справа верхней и средней доли, слева верхней доли на фоне тромбоэмболии в мелкие и средние ветви лёгочной артерии из невыявленного источника.
- Дыхательная недостаточность II степени.
Лечение
С учётом стабильности гемодинамики и отсутствия признаков высокого риска тромболизис (растворение тромбов в сосудах) пациенту не проводился, что не противоречит действующим рекомендациям.
Назначено лечение:
- Антикоагулянтная терапия (способствует более медленному свёртыванию крови и препятствует образованию тромбов): гепарин в дозе 1000 МЕ/час с последующим переходом на антикоагулянты непрямого действия — варфарин.
- Чтобы восстановить параметры сердца и для профилактики прогрессирования лёгочной гипертензии, назначена небольшая доза ингибитора ангиотензинпревращающего фермента (эналаприл 2,5 мг/сутки).
30.10.14 после проведённого лечения на контрольных томограммах сохраняются дефекты в нижнедолевых ветвях обоих лёгких протяжённостью 15 мм, слева они распространяются в сегментарные ветви 9 и 10 сегментов. Справа сохраняются дефекты сегментарных ветвей 1 и 2 сегментов.
В паренхиме (ткани) лёгких очаговые и инфильтративные изменения не определяются. По настоянию родственников пациент с незначительной положительной динамикой был переведён в пульмонологическое отделение ГКБ № 33 г. Екатеринбурга. В рамках этой госпитализации пациенту была проведена тромболитическая терапия стрептокиназой, а также замена варфарина на ривароксабан.
После выписки из ГКБ № 33 пациент был направлен в Новосибирск для решения вопроса о хирургическом лечении в условиях научно-исследовательского института (НИИ) патологии кровообращения имени Мешалкина.
13.01.15 при перфузионно-вентиляционной синциографии лёгких (ПВСЛ) выявлены сегментарные дефекты перфузии (сниженный захват радиофармпрепарата миокардом) в бассейнах левой и правой лёгочной артерии, дефекты вентиляции не выявлены.
19.01.15 был установлен кавафильтр («ловушка для тромбов») в нижнюю полую вену.
27.01.15 проведена тромбэндартерэктомия (удаление атеросклеротических бляшек и восстановление проходимости сосудов) из ветвей лёгочной артерии.
После выписки из стационара пациент отмечал положительную динамику, выраженность одышки уменьшилась.
Пациент продолжает регулярный приём ривароксабана 20 мг 1 раз в сутки. Для коррекции лёгочной гипертензии принимал силденафил 20 мг 3 раза в сутки в течение 1 месяца, затем илопрост (Вентавис) 5 мг 6 раз в сутки под контролем артериального давления в течение 1 месяца (отмена по экономическим причинам).
17.02.15 при исследовании маркеров тромбофилии в МАУ «Клинико-диагностический центр» выявлен полиморфизм (многообразие) гена ингибитора активатора плазминогена I (PAI I) — 4G/4G, гена рецепторов тромбоцитов ITGA2 (C/T) и ITGB3 (С/С). То есть патология пациента связана с генетической мутацией, которая передалась ему от одного из родителей.
22.07.15 при контрольной оценке состояния внутрисердечной гемодинамики на ЭХОКГ выявлена значимая положительная динамика в виде уменьшения размеров правых камер сердца, снижения давления в лёгочной артерии до 41 мм рт. ст., нормализации формы потока в лёгочных артериях.
Клинически состояние пациента также улучшилось: уменьшилась одышка и слабость, пациент вернулся к умеренной физической активности и к труду (сидячая работа за компьютером). Качество жизни и прогноз этого пациента улучшились благодаря предпринятым усилиям врачей после постановки диагноза.
Заключение
Длительный период от момента первичного обращения (апрель 2014) до постановки диагноза (октябрь 2014) повлияли на течение заболевания и произошедшие изменения внутрисердечной и пульмональной гемодинамики, а также на прогноз для жизни молодого пациента.
«Маски» ТЭЛА разнообразны. Низкая настороженность врачей в отношении этого заболевания в данном клиническом случае была обусловлена, по всей видимости, отсутствием традиционных факторов риска: курения, ожирения, сахарного диабета, варикозной болезни или тромбофлебита, малоподвижности.
В сложных клинических случаях у пациентов молодого возраста без явных факторов риска венозных тромбоэмболий, своевременное проведение таких доступных неинвазивных методов диагностики как ЭКГ и ЭХОКГ позволит заподозрить ТЭЛА.