По данным Росстата, количество пациентов со злокачественными новообразованиями растёт: впервые данный диагноз был установлен в 2014 году у 510 500 человек. В 2015 году эта патология была обнаружена уже у 524 300 человек, а в 2016 году — у 530 500 человек. Это может быть связано как с увеличением заболеваемости, так и с улучшением диагностики. Смертность от онкологических заболеваний составляет примерно 300 000 человек в год.
Болевой синдром при онкозаболеваниях встречается у 24-86% пациентов в процессе лечения злокачественной опухоли и у 21-46% пациентов в стадии ремиссии. С учётом наличия в России более 3 400 000 таких пациентов, становится очевидным, что количество нуждающихся в обезболивающей терапии велико, тем более, что в терминальной (последней) стадии онкологического процесса частота встречаемости боли достигает почти 100%.
Согласно определению Международной Ассоциации по изучению боли (IASP), болевое ощущение — это неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения.
Острая боль является нормальным ответом организма на воздействие повреждающего агента на ткани. Хроническая боль длится более трёх месяцев и выходит за рамки времени, требующегося для восстановления поражённых тканей организма.
При онкологических заболеваниях боль нередко имеет несколько причин:
- первичное травмирующее воздействие опухоли — сдавление, растяжение тканей;
- выделение опухолью химических веществ (медиаторов), которые могут провоцировать боль;
- вовлечение в опухоль нервных стволов;
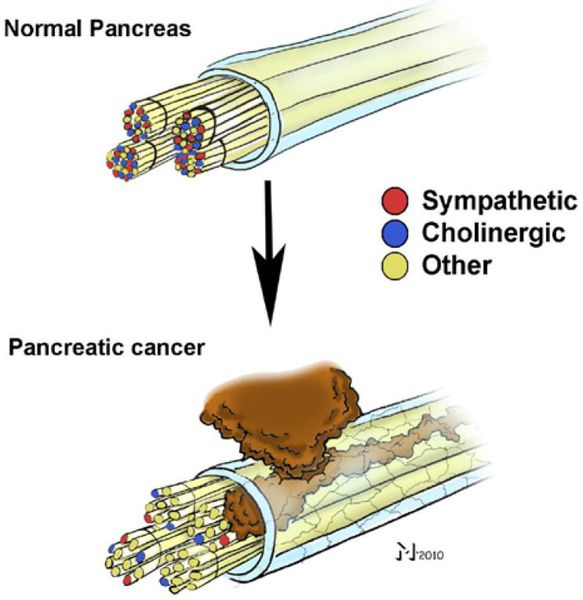
Распространение опухоли на нервные стволы
- боль вследствие длительного обездвиживания лежачего пациента и изменения метаболизма тканей;
- боль на фоне химиотерапии или облучения с поражением одного или множественных нервных волокон (полинейропатии, мононейропатии).
На восприятие и характер боли влияет также формирующаяся у большинства пациентов со злокачественными опухолями депрессия.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы болей при онкологии
Боль сама по себе является симптомом заболевания и представляет собой различной степени выраженности неприятные ощущения, которые могут по-разному ощущаться пациентами.
Боль оценивается по субъективному ощущению и описанию пациента и зависит от личностных, культурных и социальных особенностей. Используемые описания весьма разнообразны: боль может быть ноющей, грызущей, жгучей («как будто кипятком обдали», «жжёт как от крапивы»), пульсирующей, дергающей, сверлящей, тупой, режущей и т. д.
Также боль характеризуют в зависимости от остроты и длительности её присутствия: приступообразная, периодическая или постоянная. В этой ситуации очень важен тщательный опрос пациента для формирования полноты картины болевых ощущений конкретного больного. При этом всегда следует уточнять и вторичные болевые симптомы (в других зонах или другого характера, например, одновременная жгучая боль при поражении слизистой кишечника и боль тупого характера в поясничной зоне при метастазах), на которые пациент может не жаловаться, переключив всё внимание на основную боль. Это особенно важно при выборе метода хирургического лечения.
На начальной стадии онкозаболеваний болевой синдром может не беспокоить человека, так как размеры опухоли ещё не велики и не раздражают рецепторы.
Патогенез болей при онкологии
Патогенез возникновения боли является многокомпонентным, с участием:
- периферических чувствительных рецепторов;
- химических веществ — медиаторов (таких как гамма аминомасляная кислота, серотонин, эндорфины и энкефалины, простагландины, субстанция Р, глутамат, норэпинефрин, брадикинин и др.);
- проводящих путей болевой чувствительности;
- подкорковых и центральных центров ощущения и восприятия боли.
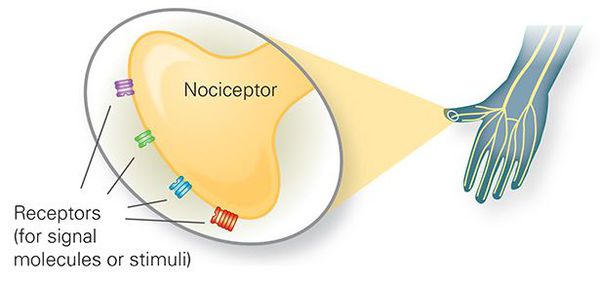
Периферические чувствительные рецепторы
Боль первично возникает при раздражении ноцицепторов (механическое, температурное или химическое раздражение), передающих ощущение по нервным волокнам (быстрые миелинизированные А-дельта волокна и медленные С-волокна) в задние рога спинного мозга, где переключаются на спиноталамический тракт противоположной стороны.
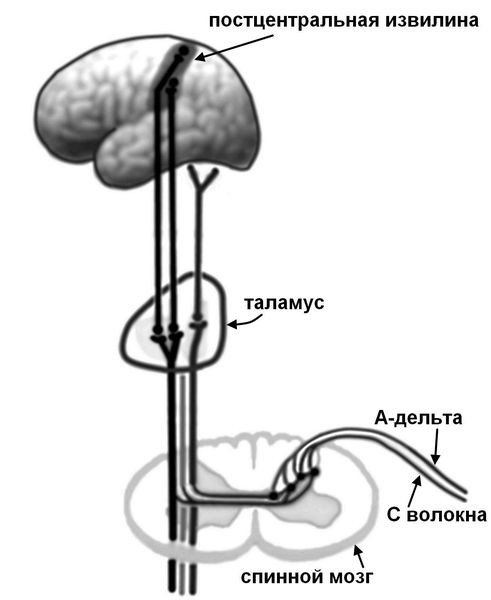
Цепочка передачи нервных импульсов
Далее импульс проходит через подкорковые центры (таламус) и оценивается в зоне чувствительной коры. При этом в анализе и оценке болевого импульса участвуют и другие различные структуры, отвечающие за память и эмоциональное восприятие (лимбическая система, островковая доля, гиппокамп, поясная извилина).
В формировании хронической боли имеет большое значение центральная сенситизация (избыточный ответ ноцицептивных нейронов в центральной нервной системе на нормальное или подпороговое раздражение). Противоболевая система работает за счёт подавления активности интернейронов (промежуточных нервных клеток) в задних рогах спинного мозга. Противоболевые стимулы могут исходить из коры передних отделов поясной извилины, миндалевидного тела, гипоталамуса, с участием серого вещества около водопровода мозга, ядер продолговатого мозга.
Классификация и стадии развития болей при онкологии
Классификация боли может быть проведена по нескольким критериям:
- по области боли:
- локальная (голова, живот, конечности и т. д.);
- генерализованная;
- по отношению к органу или системе, которая является причиной боли (нервная система, костно-мышечная система, желудочно-кишечный тракт и т. д.);
- по длительности боли:
- приступообразная;
- постоянная;
- ремиттирующая с периодами благополучия;
- по общему времени существования боли:
- острая;
- хроническая (которая существует более 3-6 месяцев);
- по выраженности болевого синдрома:
- умеренный;
- средний;
- тяжёлый;
- по механизму развития:
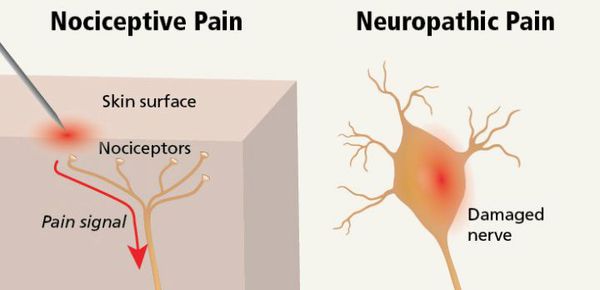
- ноцицептивная;
- нейропатическая.
Механизмы развития боли
Ноцицептивная боль возникает при повреждении тканей с раздражением тонких А и С нервных волокон (ноцицепторов). Она может быть соматической и висцеральной.
Ноцицептивная соматическая боль возникает при раздражении ноцицепторов в мышцах, костях скелета или коже. Такая боль чаще всего локализованная. Она может быть как периодической, так и постоянной, по характеру — тупой, острой, давящей, пульсирующей, дёргающей, сверлящей, грызущей, распирающей и др.
Ноцицептивная висцеральная боль возникает вследствие раздражения ноцицепторов в органах с значительной симпатической иннервацией (полые органы или гладкая мускулатура). Обычно она разлитая, менее локализованная, чаще тупая хроническая с эпизодами усиления, нередко описывается как сжимающая, тянущая, схваткообразная.
Нейропатическая боль — следствие заболевания или повреждения соматосенсорной нервной системы (с первичным поражением периферических нервов или вследствие поражения центральной нервной системы). Она может сопровождать ноцицептивные болевые синдромы или быть самостоятельной — постампутационные боли, болевой синдром при развитии нейропатии на фоне химиотерапии, в результате вовлечения нерва в опухоль, при вирусных инфекциях, поражающих нерв (например постгерпетические нейропатии), и диабетической полинейропатии.
Специфические описательные характеристики такой боли: жгучая, стреляющая, «как будто облили кипятком», «жжёт как от крапивы». Кожная чувствительность в зоне такой боли обычно снижена и, как правило, сопровождается парестезиями и гиперпатией (возникновением неприятных или болевых ощущений при малейшем прикосновении — например, при ношении одежды и т.д.).
Осложнения болей при онкологии
Осложнения при хроническом болевом синдроме в значительной степени связаны с прогрессированием и осложнениями основного заболевания и проводимой лекарственной терапией.
Использование наркотических анальгетиков может приводить к запорам, тошноте, сонливости, формированию физической, реже — психической зависимости, в редких случаях передозировки — к снижению артериального давления и дыхательным нарушениям.
Инвазивные методы лечения боли также имеют свои специфические для каждого вида процедуры или операции осложнения. Отсутствие достаточного контроля за болью ведёт к снижению качества жизни, нарушениям сна, депрессии, нарушению социализации и т.д.
Болевой синдром совместно с другими осложнениями онкозаболеваний (чувством усталости и эмоциональным истощением) может стать причиной экзистенциального стресса больного. Приступы боли приводят к тревожности пациента в связи со страхом рецидива боли. По этой причине важна психотерапевтическая поддержка больных с болевым синдромом.
Диагностика болей при онкологии
Боль — это субъективное ощущение пациента, не поддающееся оценке с помощью инструментальных или лабораторных исследований, которые могут только оценить возможные причины боли, но не интенсивность и переносимость боли пациентом.
Главным инструментом в диагностике боли остаётся беседа с пациентом, которая позволяет детализировать индивидуальный характер болевого синдрома. Для оценки степени болевого синдрома применяется визуально-аналоговая шкала боли.
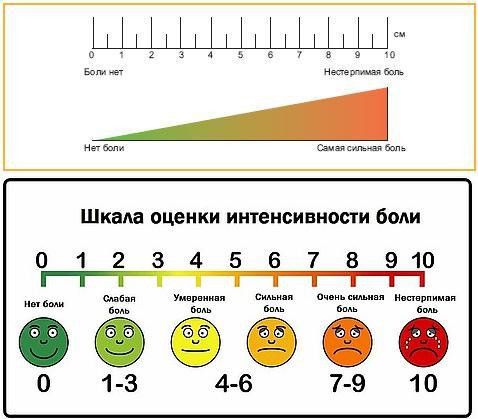
Визуально-аналоговая шкала, по которой оценивается интенсивность боли
Кроме шкалы боли существует большое количество шкал по оценке качества жизни и болевого синдрома, такие как Pain Detected, QLS и другие, позволяющие дополнить информацию, полученную по визуально-аналоговой шкале и со слов пациента.
Оценка боли может быть прямой (от пациента), так и непрямой (на основе поведения, психологической оценки). Исследуются также возможности проведения магнитнорезонансной томографии для оценки болевого синдрома. Применяются методы функциональной МРТ, МРТ перфузии, оценки изменения объёма и плотности серого и белого вещества в зонах, участвующих в перцепции боли. С помощью трактографии оценивают количество и зоны связей в белом веществе головного мозга.
Методом электроэнцефалографии проводится оценка функциональной активности головного мозга и формирования патологических связей. В оценке и формировании хронического болевого синдрома участвует большое количество центров головного мозга (такие как островок, поясная извилина, сенсомоторная кора, таламус, серое вещество водопровода мозга и голубое пятно) со сложными связями между собой и с другими участками головного мозга.
Однозначной трактовки информации, полученной с помощью МРТ и ЭЭГ, о взаимоотношении всех этих структур на сегодняшний день не сформировано, и пока это не применяется в рутинной практике.
Лечение болей при онкологии
Согласно рекомендациям Всемирной организации здравоохранения и клиническим рекомендациям, медикаментозное лечение боли включает в себя трехступенчатую схему.
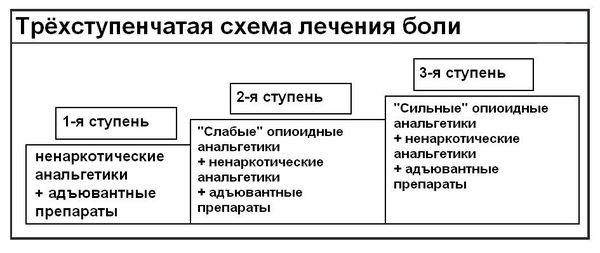
Этапы устранения боли
Применение ненаркотических анальгетиков (неопиоидов) — первый этап лечения хронической боли слабой и средней интенсивности. Препараты, используемые на этой ступени: аспирин, парацетамол и другие анальгетики-антипиретики. На этой стадии возникают ограничения терапии вследствие побочных действий препаратов и наличия «потолка» обезболивания (дальнейшее наращивание дозы препарата уже не усиливает обезболивающий эффект).
Вторая ступень характеризуется усилением боли, несмотря на повышение дозы препаратов первой ступени. К слабым опиатам, назначаемым на этой ступени, относятся кодеин, дионин, и трамал (трамадол). Эти препараты представлены в различных формах выпуска, удобных для использования пациентом (капсулы, капли, свечи и ампулы).
Дальнейшее нарастание болевого синдрома и недостаточный эффект от проводимого лечения требует использования препаратов третьей ступени — просидола, норфина (нопен, бупренорфин), морфина, дюрогезика. Формы выпуска также могут быть разные — ампулы, таблетки, сублингвальные таблетки, свечи, пластырь.
Однако, даже соблюдение рекомендаций не решает всех проблем, связанных с медикаментозной терапией, таких как развитие толерантности (устойчивости) к препаратам и возникновение физической зависимости от них. Появление психической зависимости при использовании адекватно подобранной терапии наркотическими анальгетиками встречается гораздо реже, но всё же возможно. Часть проблем решается комбинацией препаратов и добавлением дополнительной (адъювантной) терапии (такие препараты, как кортикостероиды, антидепрессанты, противосудорожные препараты).
По данным ВОЗ около 20-30% пациентов всё равно не получают достаточного обезболивания даже при адекватно проводимой терапии. В связи с этим разумным представляется необходимость комплексного подхода к пациентам с болевым синдромом, в котором должно быть место и инвазивным методам лечения боли (от малотравматичных (через прокол) — так называемые пункционные вмешательства, до открытых нейрохирургических вмешательств). К терапии таких пациентов должен привлекаться и специалист по лечению боли — это может быть нейрохирург, квалифицирующийся на лечении болевого синдрома, и/или анестезиолог).
В то время, как медикаментозная противоболевая терапия имеет системные рекомендации и может быть проведена в должном объёме, осуществление интервенционного (с помощью хирургических манипуляций) лечения боли пока не получило достаточного практического развития в России.
Интервенционные методы лечения боли
К интервенционным методам терапии относятся:
- химическая нейромодуляция (введение анальгетиков в эпидуральное пространство или спинномозговую жидкость — так называемые «морфиновые помпы»);
- электрическая нейромодуляция (электрическая стимуляция ядер головного мозга, проводников болевой чувствительности спинного мозга, периферических нервов);
- нейролиз (разрушение) периферических нервов и сплетений (солнечное, верхнее подчревное, непарный ганглий) химическим или радиочастотным методами;
- операции по пересечению проводящих путей болевой чувствительности;
- деструктивные операции на центрах болевой чувствительности головного мозга.
Химическая нейромодуляция
Суть этого метода лечения — доставка препарата максимально близко к зоне его активности.
При эпидуральном введении обезболивающий препарат (чаще это опиоидные анальгетики) вводится в позвоночный канал в пространство над оболочками спинного мозга с помощью специальных систем. Данный метод не позволяет значительно снизить дозу препарата по сравнению с инъекционным или пероральным приемом, сохраняется системное воздействие препарата на организм вследствие всасывания из эпидурального пространства, отмечается относительно высокий риск воспалительных осложнений.
При субарахноидальном введении препарат вводится непосредственно в спинномозговую жидкость с помощью специальных помп, что позволяет (на примере морфина) снизить дозу препарата до 300 раз по сравнению с системным приемом. Однако существующие практические ограничения использования морфиновых помп не могут обеспечить потребности всех нуждающихся в этом пациентов.
Возможными осложнениями такого вида лечения могут быть:
- гормональные нарушения;
- воспалительные осложнения на фоне инородного тела (помпы);
- гранулёма в области катетера помпы, затрудняющая выделение препарата по катетеру;
- при использовании опиоидных анальгетиков возможно возникновение гипералгезии (повышенной чувствительности с неприятным болезненным ощущением);
- при использовании опиоидных анальгетиков возможно возникновение миоклонусов (непроизвольных вздрагиваний) в конечностях;
- при использовании высоких доз опиоидных анальгетиков возможна блокада дыхательного центра.
Часть этих осложнений, возможно, будет решена с помощью новых препаратов, например, такого как исследующийся в последние годы циконотид, не являющийся родственником опиатов и имеющий меньший риск формирования привыкания и блокады дыхательного центра. Однако и этот препарат имеет значительное количество побочных эффектов, которые также ограничивают его применение.
Электрическая нейромодуляция
Данная процедура заключается в электрической стимуляции периферического нерва, проводящих путей болевой чувствительности спинного мозга или стимуляции ряда центров головного мозга (ядра таламуса, серого вещества водопровода головного мозга, двигательной коры). Подобная электростимуляция обладает сложным, комплексным и не до конца изученным механизмом действия, однако для простоты понимания можно сказать, что она уменьшает проведение болевой импульсации в центры болевой чувствительности головного мозга (при стимуляции спинного мозга или периферических нервов) или изменяет восприятие боли при стимуляции центров в головного мозге.
Нейролиз периферических нервов и вегетативных сплетений химическим или радиочастотным методом
Нейролиз периферического нерва проводится:
- при развитии боли в зоне одного чувствительного нерва;
- при смешанной иннервации нерва (чувствительной и двигательной), когда потеря движений, обусловленных этим нервом, не имеет значения для пациента (например один межреберный нерв), или когда движения в этой зоне уже утрачены вследствие основного заболевания.
Нейролиз вегетативных нервных сплетений показан пациентам с ноцицептивной висцеральной болью при онкологии органов брюшной полости и органов малого таза. Методика является максимально щадящей для пациента и проводится пункционно (прокол иглой для доставки химического агента или радиочастотного электрода) под рентгенологическим контролем, реже используется УЗИ или МРТ- навигация.
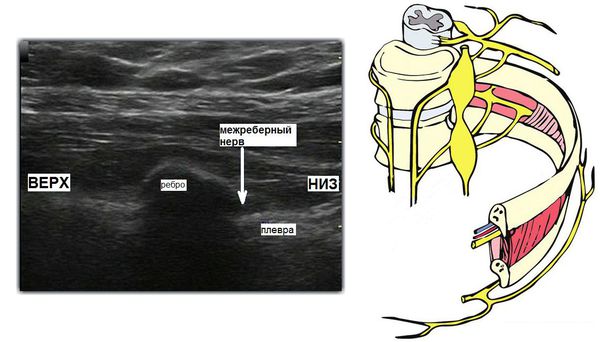
Визуализация зоны межрёберного нерва под ультразвуковым контролем для проведения блокады или радиочастотной деструкции межрёберного нерва
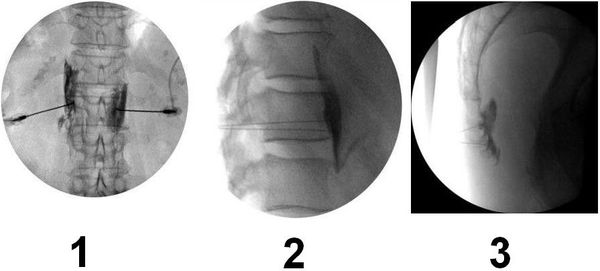
1,2 — визуализация зоны солнечного сплетения, 3 — визуализация непарного ганглия
Операции по пересечению проводящих путей болевой чувствительности
Суть операций заключается в пересечении путей проводящих болевую чувствительность от очага боли к анализирующим центрам головного мозга на уровне спинного мозга или ствола мозга.
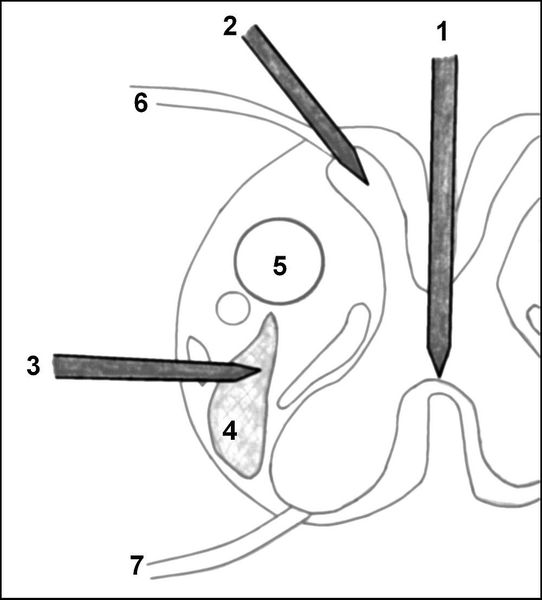
Схема операций по пересечению проводников болевой чувствительности на уровне спинного мозга (на поперечном срезе спинного мозга)
1 — срединная миелотомия; 2 — разрушение зоны вхождения заднего чувствительного нервного корешка в спинной мозг (DREZ-отомия); 3 — хордотомия; 4 — спиноталамический тракт (проводящие пути болевой чувствительности); 5 — кортикоспинальный тракт (проводник двигательных импульсов); 6 — задний (чувствительный) нервный корешок; 7 — передний (двигательный) нервный корешок
Срединная миелотомия заключается в пересечении перекреста спиноталамического тракта и применяется в случае двусторонних болей при срединных (онкология грудной клетки, брюшной полости, нижних конечностей) или при многоочаговых поражениях нижней половины тела.
DREZ-отомия используется для выключения односторонней боли в конечности (при онкологическом поражении, травме нервных корешков, иннервирующих конечность с грубым нарушением функции конечности).
Хордотомия заключается в пересечении спиноталамического тракта. Может выполняться как малоинвазивно — через прокол под контролем компьютерного томографа на верхнешейном уровне, так и в виде открытой операции на грудном уровне. Хордотомия используется для лечения одностороннего ноцицептивного соматического болевого синдрома. Применение двусторонней хордотомии на шейном уровне возможно, но имеет более высокие риски дыхательных нарушений.
Деструктивные операции на центрах болевой чувствительности головного мозга
Наиболее типичной операцией является стереотаксическая двусторонняя цингулотомия, которая может применяться при большинстве болевых синдромов. При этом меняется центральное восприятие боли, а также возникает некоторый антидепрессивный эффект, который облегчает переносимость остаточной боли и улучшает качество жизни.
Решение вопроса о возможности оперативного лечения и виде операций окончательно принимает нейрохирург после оценки состояния пациента, истории заболевания, обследований и в согласовании с основным лечащим врачом такого пациента (врачом-онкологом).
Прогноз. Профилактика
Прогноз у пациентов с онкологической болью определяется преимущественно течением основного заболевания.
Профилактика развития болевых синдромов при онкологической патологии трудна и заключается обычно в следующем:
- проведение адекватной терапии с соблюдением принципов осуществляемой медикаментозной терапии:
- принимать препараты по расписанию, а не по желанию;
- начинать лечение ненаркотическими анальгетиками с дальнейшим переходом при необходимости к слабым, а затем сильным опиатам;
- строго соблюдать дозы и схемы приёма;
- приём препаратов через рот должен осуществляться как можно дольше — это самый удобный способ приёма препаратов для больного, особенно в домашних условиях;
- препараты с плацебо-эффектом не должны применяться для лечения боли у онкологических больных;
- комплексный подход к ведению пациента — своевременная хирургия в максимально возможном объёме, назначение лучевой и химиотерапии, правильная медикаментозная противоболевая терапия, участие нейрохирурга в оценке трудно купируемых болевых синдромов, психологическая и социальная реабилитация.
Список литературы
- Демографический ежегодник России. 2017: Стат. сб. / Росстат. — M., 2017. — 263 c.
- Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи / Клинические рекомендации. — 2016. — 60 с.
- Брюзгин В.В. Лечение хронической боли у онкологических больных // IV Российская онкологическая конференция. — 2000.
- The International Association for the Study of Pain. [Элекстронный ресурс]. Дата обращения: 02.10.2018.
- Федеральная государственная служба статистики. [Электронный ресурс]. Дата обращения: 02.10.2018.
- Каприн А.Д. и соавт. Фармакотерапия хронического болевого синдрома у онкологических пациентов. – М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России, 2015. — 48 с.
- Dermot R. Cancer Pain: Assessment, Diagnosis, and Management // Lippincott Williams & Wilkins. — 2010. — 464 p.
- Cancer Pain: Assessment and Management. 2 Ed / E.D. Bruera, R.K. Portenoy // Cambridge University Press. — 2009.
- Konrad P. Dorsal root entry zone lesion, midline myelotomy and anterolateral cordotomy // Neurosurg Clin N Am. — 2014. — P. 699-722.
- Stauss I., Berger A., Ben Moshe S., Arad M., et al. Double Anterior Stereotactic Cingulotomy for Intractable Oncological Pain // Stereotact Funct Neurosurg. — 2017; 95:400-408.
- Gebhart G.F., Schmidt R.F. Encyclopedia Of Pain. 2 Ed // Springer-Verlag. — 2013.
- Menon J.P. Intracranial Ablative Procedures for the Treatment of Chronic Pain // Neurosurg Clin N Am. — 2014. — P. 663-670.
- Bolash R., Mekhail N. Intrathecal pain pumps: indications, patient selection, techniques, and outcomes // Neurosurg Clin N Am. — 2014. — P. 735-742.
- Neuroimaging of Pain / Saba L. // Springer International Publishing — 2017.
- Gilron I., Baron R., Jensen T. Neuropathic pain: principles of diagnosis and treatment // Mayo Clin Proc. — 2015; 90(4):532-45.
- Raslan A.M., Burchiel K.J. Neurosurgical Advances in Cancer Pain Management // Curr Pain Headache Rep. — 2010; 14(6):477-82.
- Charles F. von Gunten. Pathophysiology of Pain in Cancer // J Pediatr Hematol Oncol. — 2011; 33:12-18.
- Van den Beuken-van Everdingen M.H., de Rijke J.M., Kessels A.G., Schouten H.C. Prevalence of pain in patients with cancer: A systematic review of the past 40 years // Ann Oncol. — 2007; 18(9):1437-49.
- World Health Organization. WHO’s pain relief ladder for cancer pain relief. — Sept, 2015.
- Brookes M.E., Eldabe S., Batterham A. Ziconotide Monotherapy: A Systematic Review of Randomised Controlled Trials // Curr Neuropharmacol. — 2017; 15(2):217-31.
- Куприянова И.Е., Тузиков С.А., Гураль Е.С. Качество жизни и психические расстройства у пациентов с онкологическими заболеваниями различных локализаций // Сибирский онкологический журнал. — 2014. — №2. — С. 65-70.