Синдром Стивенса — Джонсона (Stevens — Johnson syndrome) — это острая и опасная для жизни аллергическая реакция, вызванная инфекцией или приёмом некоторых препаратов. При болезни на коже и слизистых оболочках образуются пузыри, а после их вскрытия появляются эрозии. В результате кожа и слизистые утрачивают свои защитные свойства, что может привести к тяжёлым инфекционным осложнениям .
Синдром Стивенса — Джонсона и токсический эпидермальный некролиз (синдром Лайелла) рассматриваются как разные по тяжести варианты одного патологического процесса.
Впервые синдром был описан Альбертом Стивенсом и Фрэнком Джонсоном в 1922 году.
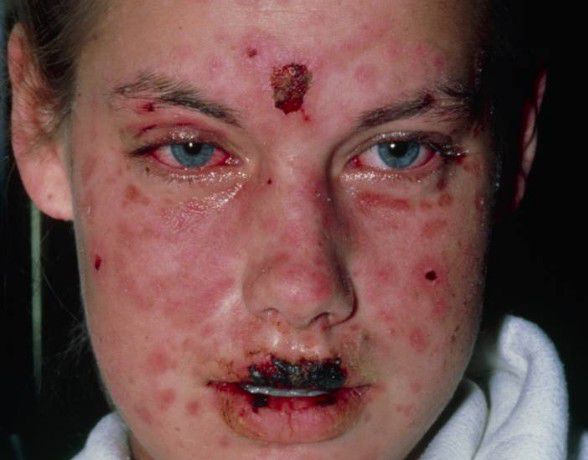
Синдром Стивенса — Джонсона [33]
Распространённость синдрома Стивенса — Джонсона
Синдром Стивенса — Джонсона возникает в 1–6 случаях на миллион человек в год . Заболевание может развиться в любом возрасте. У детей болезнь чаще рецидивирует, т. е. возникает повторно, но смертность выше среди пожилых пациентов. Синдром более распространён среди азиатов и людей с тёмной кожей.
Болезнь чаще встречается зимой и ранней весной, что подтверждает роль инфекции в её развитии .
Факторы риска
Синдром Стивенса — Джонсона чаще развивается у пациентов со злокачественными опухолями, системной красной волчанкой, туберкулёзом, ВИЧ/СПИДом, острыми и хроническими заболеваниями почек. Неясно, связан ли синдром с основным заболеванием или является его осложнением, либо возникает из-за лекарств, которые принимают пациенты.
Если синдром Стивенса — Джонсона уже развивался после приёма лекарств, повышается риск рецидива при приёме другого препарата того же класса.
Также возможна перекрёстная реактивность между лекарствами — реакция организма на схожие вещества, например аллергия на пенициллины повышает вероятность аллергии на цефалоспорины. Противоэпилептические препараты (Карбамазепин, Фенитоин и Фенобарбитал) тоже схожи по составу и могут иметь перекрёстную реактивность .
К генетическим факторам риска относится определённый набор антигенов гистосовместимости (HLA — human leukocyte antigens). На поверхности всех клеток организма есть белки, которые называют антигенами главного комплекса гистосовместимости. Этот набор белков индивидуален для каждого человека. Антигены помогают организму отличать свои клетки от чужеродных агентов, выявлять заражённые или опухолевые клетки и активировать иммунный ответ.
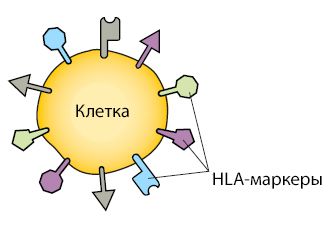
HLA-маркеры на поверхности клетки
Склонность к развитию синдрома Стивенса — Джонсона возникает при следующих вариантах генах HLA:
- HLA-B*5801 — после приёма Аллопуринола;
- HLA-B*1502 — Карбамазепина, Ламотриджина, Окскарбазепина, Фенобарбитала, Дифенина;
- HLA-B*1511 и HLA-B*3101 — Карбамазепина .
Причины синдрома Стивенса — Джонсона
У взрослых примерно в 85 % случаев синдром Стивенса — Джонсона развивается после приёма лекарств. Остальные случаи связаны с инфекций либо с неизвестными причинами. Когда доктор не может выявить причину синдрома, заболевание называют идиопатическим.
У детей лекарства и инфекции в равной степени приводят к развитию синдрома .
Известно более 200 препаратов, провоцирующих развитие синдрома Стивенса — Джонсона. К ним относятся Аллопуринол, Карбамазепин, Ламотриджин, Невирапин, Фенобарбитал, Фенитоин, Сульфаметоксазол, Сульфасалазин, Сертралин, нестероидные противовоспалительные (например, Мелоксикам, Пироксикам, Теноксикам), химиотерапевтические и противораковые препараты .
Предположительно, синдром Стивенсона — Джонсона в очень редких случаях может развиться после вакцинации. В США описано всего шесть таких случаев. Они возникали после применения вакцины от гепатита B, гриппа, ветряной оспы, гемофильной палочки, кори, паротита и краснухи. Во всех этих случаях была введена как минимум одна противовирусная вакцина .
У детей до 15 лет заболевание может развиться после приёма следующих препаратов:
- Ацетаминофена — в 37 % от всех случаев;
- Фенобарбитала — 15 %;
- сульфаниламидов — 13 %;
- цефалоспоринов — 10 %;
- Вальпроевой кислоты — 9 %;
- Ламотриджина — 9 %;
- макролидов — 7 %;
- Карбамазепина — 5 % .
Также синдром Стивенса — Джонсона может развиваться под влиянием вируса герпеса. Изучаются и другие причины, например связь с бактерией Mycoplasma pneumoniae.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы синдрома Стивенса — Джонсона
Как правило, симптомы появляются в течение нескольких недель после начала приёма нового препарата. Иногда этот период увеличивается до восьми недель. Человек чувствует недомогание, кашляет, у него повышается температура, болит голова и воспаляются глаза. В некоторых случаях первым признаком болезни становится распространённое покраснение кожи.
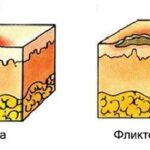
Затем на лице, шее, туловище, ладонях и стопах внезапно появляются пятна. Они сливаются с крупными пузырями, которые вскрываются в течение 1–3 дней, образуя эрозии.
Для синдрома Стивенса — Джонсона характерны болезненность кожи и слизистых оболочек. Почти у 90 % больных отслаивается эпидермис, образуются болезненные корки и эрозии во рту, воспаляются глаза, появляются высыпания на половых органах. Вместе с эпидермисом могут отторгаться ногти, брови и волосы.
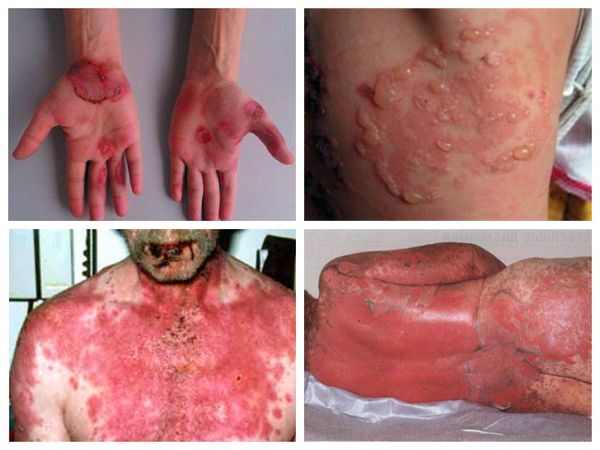
Пятна и пузыри при синдромах Стивенса — Джонсона и Лайелла
Наиболее тяжёлое поражение возникает на слизистых оболочках полости рта, носа, половых органов, коже красной каймы губ и в перианальной области. На этих участках появляются пузыри, которые быстро вскрываются, обнажая обширные, резко болезненные эрозии, покрытые сероватым налётом. На красной кайме губ часто образуются толстые буро-коричневые кровянистые корки. При поражении глаз наблюдается блефароконъюнктивит, может развиться язва роговицы и увеит .
Также при болезни часто отслаивается эпителий бронхов, что сопровождается кашлем и нарушением дыхания. Может развиться пневмония, отёк лёгких, острые поражения почек и печени, такие как гломерулонефрит и гепатит .
Патогенез синдрома Стивенса — Джонсона
Механизм развития синдрома Стивенса — Джонсона до конца не изучен. Известно, что заболевание сопровождается массовой гибелью клеток кожи и эпителия слизистых оболочек. Клетки гибнут из-за воспаления, вызванного неадекватным иммунным ответом. К такому воспалению могут приводить нарушения при выведении из организма лекарственного препарата. В этом случае молекулы лекарства, взаимодействуя с клетками организма, становятся антигенами — иммунная система воспринимает их как потенциально опасные и начинает вырабатывать против них антитела.
В результате в клетках кожи запускаются цитотоксические (разрушающие) реакции. В основе этих механизмов лежит отсроченная аллергическая реакция IV типа. Она заключается в иммунном ответе на образовавшийся комплекс, состоящий из антигенов и антител .
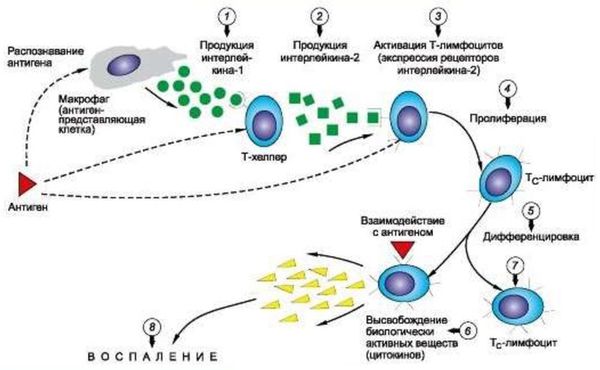
Общая схема аллергической реакции IV типа
Во время этих реакций цитотоксические Т-лимфоциты уничтожают клетки кожи. В норме такие лимфоциты избавляют организм от повреждённых клеток, например заражённых вирусами, или клеток опухолей.
Т-лимфоциты синтезируют специфические белки и молекулы, которые участвуют в иммунном ответе. К таким молекулам относятся цитокины, гранулизин, факторы некроза опухоли (TNF), интерфероны и т. д. Интересно, что концентрация гранулизина в жидкости волдыря напрямую связана с тяжестью синдрома Стивенса — Джонсона .
Классификация и стадии развития синдрома Стивенса — Джонсона
В Международной классификации болезней (МКБ-10) синдром Стивенса — Джонсона кодируется как L51.1. Вместе с токсическим эпидермальным некролизом (синдромом Лайелла, L.51.2) они включены в рубрику L51«Эритема многоформная».
Эти два заболевания различаются по площади поражённой кожи:
- Синдром Стивенса – Джонсона (малая форма) — поражено менее 10 % кожи.
- Промежуточная, или переходная форма (в англоязычной литературе «overlapping») — поражено 10–30 % кожи.
- Токсический эпидермальный некролиз (синдром Лайелла) — более 30 % кожи .
Осложнения синдрома Стивенса — Джонсона
- Кожные осложнения: бактериальная инфекция, гипо- или гиперпигментация кожи, потеря или истончение ногтей, формирование рубцов и облысение.
- Осложнения со стороны глаз: конъюнктивит, кератит, эрозия роговицы, синдром сухого глаза, боязнь света. Заболевания глаз могут привести к слепоте.
- Осложнения со стороны желудочно-кишечного тракта: постоянная сухость и эрозии полости рта, сужение пищевода, перианальный абсцесс (скопление гноя под кожей вокруг ануса).
- Осложнения со стороны мочеполовой системы: острая почечная недостаточность, кровотечения из мочевого пузыря, баланопостит, сужение уретры, хронические эрозии половых органов, вульвовагинит и стеноз влагалища.
- Лёгочные осложнения: пневмония.
- Гематологические осложнения: снижение количества клеток, отвечающих за иммунную защиту, перенос железа и свёртывание крови (лейкопения, анемия, тромбоцитопения и нейтропения).
- Сепсис. При тяжёлом течении отслаиваются большие участки эпидермиса, а на коже и слизистых оболочках образуются обширные эрозии. Повреждения сопровождаются водно-электролитными нарушениями и массивной потерей белка. На фоне этих процессов и утраты барьерной функции кожи может развиться сепсис .
Диагностика синдрома Стивенса — Джонсона
Диагностика основана прежде всего на оценке клинических проявлений. В том числе разработан алгоритм самодиагностики.
Самодиагностика
Немедленно обратиться к врачу следует при наличии двух и более признаков:
- волдыри, пузыри или красные пятна на коже;
- пузыри на слизистой — во рту, глазах, ушах, носу и области гениталий;
- лихорадка;
- отёк век и покраснение глаз;
- симптомы, напоминающие грипп: ломота в теле, слабость и разбитость;
- приём новых препаратов в предшествующие восемь недель, особенно антибиотиков, противосудорожных и противоопухолевых средств.
Крайне важно распознать ранние симптомы и немедленно обратиться за медицинской помощью. Своевременное лечение поможет спасти жизнь пациенту и предотвратить осложнения болезни .
Осмотр
Для синдрома Стивенса — Джонсона характерен положительный симптом Никольского. Чтобы оценить его, врач тянет пинцетом за покрышку пузыря: если при этом отторгается лента здоровой кожи, то симптом считается положительным. Такая же реакция происходит при трении кожи между пузырями. Она связана с нарушенной связью между клетками в слоях эпидермиса.
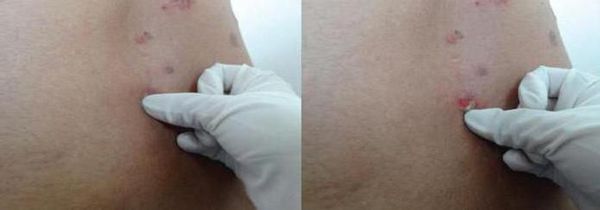
Симптом Никольского [40]
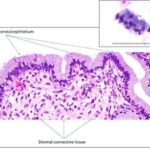
Биопсия
Биопсия кожи позволяет подтвердить диагноз и исключить тяжёлые поражения кожи, например стафилококковый синдром ошпаренной кожи.
Лабораторная диагностика
Биохимия, коагулограмма, анализ крови и мочи проводятся для подбора заместительной, противовоспалительной и антибактериальной терапии, а также для профилактики осложнений .
Ежедневно до стабилизации состояния проводится общий анализ мочи и развёрнутый общий анализ крови. Также проводится биохимический анализ крови: оценивается уровень глюкозы, мочевины, креатинина, общего белка, билирубина, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), С-реактивного белка (СРБ), фибриногена, кислотно-щелочное состояние (КЩС).
Посевы с кожи и слизистых оболочек, бактериологическое исследование мокроты, фекалий проводятся по показаниям. Микробиологическое исследование позволяет выявить бактерии и грибки, определить их чувствительность к препаратам и подобрать эффективную и безопасную терапию. Соскоб для исследования берётся с трёх участков повреждённой кожи .
Если лекарственная причина заболевания не подтверждена, выполняются разнообразные тесты на инфекции. Например, проводится ПЦР-тестирование на вирус простого герпеса и микоплазмы .
Кожные прик-тесты и тесты на специфический IgE при синдроме Стивенса — Джонсона бесполезны. С их помощью выявляют немедленные аллергические реакции, а синдром связан с реакциями другого типа .
Для обследования кожных высыпаний и поражения слизистых показана консультация дерматолога. При наличии признаков поражения других органов целесообразна консультация узких специалистов: отоларинголога, окулиста, уролога и др.
Дифференциальная диагностика
Синдром Стивенса — Джонсона нужно отличать от других видов эритемы, вирусной экзантемы и стафилококкового синдрома ошпаренной кожи.
При эритеме кожа обычно поражена слабее, чем при синдроме Стивенса — Джонсона: отслаивается не более 1–2 % эпидермиса .
Вирусная экзантема — это сыпь, вызванная вирусной инфекцией, чаще энтеровирусами. При диагностике важно учитывать эпидемическую обстановку и историю контактов с больными людьми. При экзантеме, как правило, возникает сыпь, но зуд и пузыри не появляются. Болезнь протекает легко, и через 3–5 дней пациент полностью выздоравливает.
У детей синдром Стивенса — Джонсона следует отличать от стафилококкового синдрома ошпаренной кожи. Как правило, при этой болезни слизистые оболочки не поражаются.
Лечение синдрома Стивенса — Джонсона
В первую очередь, нужно немедленно прекратить принимать лекарство, которое предположительно стало причиной болезни. Ранняя отмена препарата снижает смертность и риск развития осложнений .
Режим и особенности лечения
Пациентов с синдромом Стивенса — Джонсона всегда лечат в больнице: в отделении интенсивной терапии или ожоговом отделении. В ожоговое отделение обычно госпитализируют, если поражено более 10 % кожи. Своевременная госпитализация повышает выживаемость, снижает риск присоединения инфекций и сокращает время пребывания в больнице.
Лечение больного с синдромом Стивенса — Джонсона — это сложная задача, которая требует слаженной работы команды дерматологов, хирургов и офтальмологов. При необходимости привлекаются педиатры, оториноларингологи, пульмонологи, инфекционисты и гинекологи.
Тактика ведения пациентов с синдромом такая же, как и при ожогах. Чтобы предотвратить инфицирование, обеспечивают максимально стерильные условия. Пациента помещают под согревающий каркас, палата должна быть оснащена бактерицидными лампами. Температура в палате поддерживается на уровне 30–32 °C.
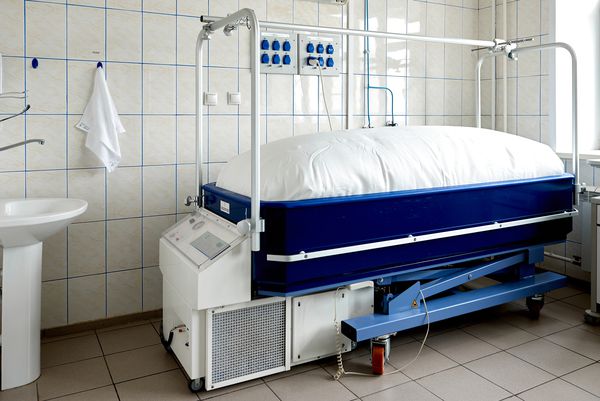
Лечебно-ожоговая кровать
Растворы для гигиенического ухода и антисептической обработки кожи и слизистых тоже должны быть тёплыми: перед применением их подогревают до 35–38 °C .
Так как больной теряет много жидкости, электролитов и белка, подбирается индивидуальное питание и восполняется потеря жидкости.
Обезболивание
Боль может быть очень сильной, поэтому часто назначаются наркотические обезболивающие препараты. При этом следует избегать приёма нестероидных противовоспалительных препаратов .
Антисептическая обработка
Для ухода за кожей применяются местные антисептики (например, Хлоргексидин, нитрат серебра, водные растворы анилиновых красителей) и аэрозоли с противовоспалительным и заживляющим действием (Полькортолон, Оксикорт). Используется одноразовое или стерильное бельё, накладываются специальные неприлипающие повязки (марля с вазелином и серебряной нитью или биосинтетические заменители кожи, например Biobrane), которые позволяют уменьшить боль и ускорить заживление.
Уход за глазами и полостью рта
Уход за глазами крайне важен. Пациента ежедневно осматривает офтальмолог, применяются глазные капли и мази, снимающие боль и воспаление (антисептики, антибиотики и кортикостероиды).
Для ухода за полостью рта используются местные оральные анестетики и жидкости для полоскания.
ИВЛ
При поражении трахеи и бронхов может потребоваться интубация и искусственная вентиляция лёгких.
Другие виды терапии
По назначению врача может приводиться физиотерапия. Процедуры позволяют поддерживать подвижность суставов и снижают риск развития пневмонии.
Для предотвращения тромбоэмболии применятся антикоагулянтная терапия, также проводится профилактика стрессовой язвы желудочно-кишечного тракта.
Если возникло слипание половых губ (синехии) и сужение утретры или влагалища, потребуется консультация хирурга и акушера-гинеколога или уролога. Врачи определят, нужна ли операция, и при необходимости проведут её.
При высоком уровне тревожности и эмоциональной неустойчивости пациенту потребуется психологическая помощь.
Специфическая терапия
Роль системных кортикостероидов в лечении синдрома Стивенса — Джонсона остаётся спорной. Некоторые врачи назначают высокие дозы кортикостероидов на короткое время в начале аллергической реакции (обычно Преднизолон в течение 3–5 дней). Однако высказываются опасения, что системные кортикостероиды могут увеличить риск развития инфекции и ухудшить заживление ран .
Применение Циклоспорина значительно снижает смертность среди пациентов с синдромом Стивенса — Джонсона, но у препарата есть противопоказания, например его нельзя применять при почечной недостаточности . Предполагается, что при коротком курсе Циклоспорина побочные эффекты не возникают. Однако у этого утверждения есть два ограничения: небольшой размер выборки и отсутствие контрольной группы из-за тяжести заболевания. Соотношение пользы и риска при использовании Циклоспорина оценивает лечащий врач .
Моноклональные антитела
Хороших результатов удаётся достичь при лечении Инфликсимабом, Ритуксимабом, Этанерцептом и рекомбинантным колониестимулирующим фактором гранулоцитов (G-KSF).
Прогноз. Профилактика
Чем старше пациент, серьёзнее сопутствующие заболевания и обширнее поражение кожи, тем хуже прогноз . Смертность от синдрома Стивенса — Джонсона в среднем составляет около 9 % . Если поражение кожи составляет менее 10 %, уровень смертности — 1–5 %. При поражении более 30 % кожи уровень смертности составляет 25–35 % и может достигать 50 % .
Кожа и слизистые оболочки восстанавливаются в течение несколько недель, при этом кожа шелушится и меняет окрас. Тяжёлые симптомы могут сохраняться несколько недель и даже месяцев.
Для прогноза смертности разработана шкала тяжести заболевания — SCORTEN. Состояние больного при поступлении в стационар оценивается по семи критериям, за положительный ответ по каждому пункту назначается один балл.
Критерии SCORTEN:
- возраст > 40 лет;
- наличие злокачественной опухоли;
- частота сердечных сокращений > 120;
- начальное отслоение эпидермиса > 10 %;
- уровень мочевины в сыворотке > 10 ммоль/л;
- уровень глюкозы в сыворотке > 14 ммоль/л;
- уровень бикарбоната в сыворотке < 20 ммоль/л.
Количество баллов и риск смерти:
- 0–1 баллов — более 3,2 %;
- 2 балла — более 12,1 %;
- 3 балла — более 35,3 %;
- 4 балла — более 58,3 %.
- 5 или более баллов — выше 90 % .
В 2019 году была предложена новая модель прогнозирования (ABCD-10):
- A: пациент старше 50 лет (один балл);
- B: уровень бикарбоната < 20 ммоль/л (один балл);
- C: есть активная злокачественная опухоль (два балла);
- D: диализ перед госпитализацией (три балла);
- 10: отслоение эпидермиса при поступлении в больницу ≥ 10 % поверхности тела (один балл).
Вероятность летального исхода:
- 0–1 балл — 3 %;
- 2 балла —12 %;
- 3 балла — 36 %;
- 4 балла — 58 %;
- > 5 баллов — 90 %.
Примерно у половины детей после перенесённого синдрома Стивенса — Джонсона развиваются психосоциальные нарушения и долгосрочные последствия со стороны кожи, глаз, почек, мочеполовой системы, желудочно-кишечного и лёгочного тракта .
Чтобы предотвратить возможные поздние осложнения, после выздоровления пациенту нужно находиться под наблюдением офтальмолога, гинеколога, пульмонолога, стоматолога, отоларинголога и при необходимости психиатра.
Профилактика синдрома Стивенса — Джонсона
Первичная профилактика сводится к настороженности при назначении лекарств, особенно детям и пациентам с аллергиями.
После перенесённого синдрома Стивенса — Джонсона нужно избегать приёма лекарственного препарата-виновника и родственных ему, так как заболевание может повториться.
Сведения об аллергической реакции необходимо зафиксировать в амбулаторной карте. Пациенту можно посоветовать носить браслет, например Medical Alert. На браслете указывается ФИО пациента, контакты его лечащего врача, причина аллергии или заболевание (например, сахарный диабет). В России браслет можно сделать на заказ, в европейских странах его выдают бесплатно на приёме у врача.

Браслет Medical Alert
Предсказать риск развития синдрома Стивенса — Джонсона можно с помощью генетического скрининга. С каждым годом этот метод становится всё более доступен, но в России он пока не распространён.
Список литературы
- Российское общество дерматовенерологов и косметологов. Федеральные клинические рекомендации по ведению больных с Синдромом Стивенса — Джонсона / токсическим эпидермальным некролизом. — М., 2015. — 11 с.
- Hsu D. Y., Brieva J., Silverberg N. B., Silverberg J. I. Morbidity and Mortality of Stevens — Johnson Syndrome and Toxic Epidermal Necrolysis in United States Adults // J Invest Dermatol. — 2016. — № 7. — Р. 1387–1397. ссылка
- Hsu D. Y., Brieva J., Silverberg N. B., Silverberg J. I. et al. Pediatric Stevens — Johnson syndrome and toxic epidermal necrolysis in the United States // J Am Acad Dermatol. — 2017. — № 5. — Р. 811–817. ссылка
- Schwartz R. A., McDonough P. H., Lee B. W. Toxic epidermal necrolysis: Part I. Introduction, history, classification, clinical features, systemic manifestations, etiology, and immunopathogenesis // J Am Acad Dermatol. — 2013. — № 2.ссылка
- Tangamornsuksan W., Lohitnavy M. Association between HLA-B*5901 and methazolamide-induced Stevens — Johnson syndrome/toxic epidermal necrolysis: a systematic review and meta-analysis // Pharmacogenomics J. — 2019. — № 3. — Р. 286–294. ссылка
- McPherson T., Exton L. S., Biswas S. et al. British Association of Dermatologists’ guidelines for the management of Stevens — Johnson syndrome/toxic epidermal necrolysis in children and young people, 2018 // Br J Dermatol. — 2019. — № 1. — Р. 37–54. ссылка
- Ng Y. С., Chen C.-B., Wu M.-Y. et al. Anticancer Drugs Induced Severe Adverse Cutaneous Drug Reactions: An Updated Review on the Risks Associated with Anticancer Targeted Therapy or Immunotherapies // J Immunol Res. — 2018. ссылка
- Levi N., Bastuji-Garin S., Mockenhaupt M. et al. Medications as risk factors of Stevens-Johnson syndrome and toxic epidermal necrolysis in children: a pooled analysis // Pediatrics. — 2009. — № 2. — Р. 297–304. ссылка
- Хакимова Р. Ф., Скороходкина О. В., Зайнетдинова Г. М. и др. Анализ клинического опыта наблюдения детей с токсическим эпидермальным некролизом // Российский вестник перинатологии и педиатрии. — 2020. — № 5. — С. 181–186.
- Горланов И. А., Леина Л. М., Милявская И. Р. и др. Детская дерматология. — М.: ГЭОТАР-Медиа, 2017. — С. 203–206.
- Дюбкова Т. П., Жерносек В. Ф. Синдром Стивенса — Джонсона — токсический эпидермальный некролиз у детей: монография. — Минск: РИВШ, 2013. — 205 с.
- Григорьев Д. В. Многоформная экссудативная эритема, синдром Стивенса — Джонсона и синдром Лайелла — современная трактовка проблемы // РМЖ. — 2013. — № 22. — С. 1073–1108.
- Creamer D., Walsh S. A., Dziewulski P. et al. U.K. guidelines for the management of Stevens-Johnson syndrome/toxic epidermal necrolysis in adults 2016 // Practice Guideline Br J Dermatol. — 2016. — № 6. — Р. 1194–1227. ссылка
- Gupta L. K., Martin A. M., Agarwal N. et al. Guidelines for the management of Stevens-Johnson syndrome/toxic epidermal necrolysis: An Indian perspective // IJDVL. — 2016. — № 6. — Р. 603–625. ссылка
- Жерносек В. Ф., Дюбкова Т. П. Синдром Стивенса – Джонсона — токсический эпидермальный некролиз у детей. Часть I. Определение, этиология, патогенез, клинические проявления, системное лечение // Педиатрическая фармакология. — 2011. — № 1. — С. 30–38.
- Stevens Johnson Syndrome Foundation. Stevens — Johnson Syndrome (SJS). — 2006.
- Schwartz R. A., McDonough P. H., Lee W. B. Toxic epidermal necrolysis: Part I. Introduction, history, classification, clinical features, systemic manifestations, etiology, and immunopathogenesis // Review J Am Acad Dermatol. — 2013. — № 2. ссылка
- Верткин А. Л., Дадыкина А. В. Синдром Стивенса – Джонсона // Лечащий врач. — 2006. — № 4. — С. 79–82.
- White K. D., Abe R., Ardern-Jones М. et al. SJS/TEN 2017: Building Multidisciplinary Networks to Drive Science and Translation // J Allergy Clin Immunol Pract. — 2018. — № 1. — Р. 38–69. ссылка
- Zimmermann S., Sekula P., Venhoff M. Systemic Immunomodulating Therapies for Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: A Systematic Review and Meta-analysis // Review JAMA Dermatol. — 2017. — № 6. — Р. 514–522. ссылка
- Спикетт Г. Клиническая иммунология и аллергология. — М.: ГЭОТАР-Медиа, 2019. — С. 234–237.
- Союз педиатров России. Федеральные клинические рекомендации по оказанию помощи детям с многоформной экссудативной эритемой и токсикодермией. — М., 2015. — 25 с.
- Лоуэлл А. Г., Кац С. И., Джилкрест Б. А. Дерматология Фицпатрика в клинической практике. — 2-е издание. — СПб.: Издательство Панфилова, 2018. — С. 490.
- Ghislain P.-D., Roujeau J.-C. Treatment of severe drug reactions: Stevens — Johnson syndrome, toxic epidermal necrolysis and hypersensitivity syndrome // Dermatology Online journal. — 2002. — № 1. ссылка
- Российская ассоциация аллергологов и клинических иммунологов (РААКИ). Федеральные клинические рекомендации по диагностике и лечению лекарственной аллергии. — M., 2014. — 20 с.
- Шабалов Н. П. Детские болезни. Том 1. — 5-е издание. — 2003. — С. 551–553.
- Finkelstein Y., Soon G. S., Acuna P. et al. Recurrence and outcomes of Stevens-Johnson syndrome and toxic epidermal necrolysis in children // Pediatrics. — 2011. — № 4. — Р. 723–728. ссылка
- Wang C.-W., Yang L.-Y., Chen C.-Y. et al. Randomized, controlled trial of TNF-α antagonist in CTL-mediated severe cutaneous adverse reactions // J Clin Invest. — 2018. — № 3. — Р. 985–996. ссылка
- Sica-Chapman A., Williams G., Soni N. Granulocyte colony-stimulating factor in toxic epidermal necrolysis (TEN) and Chelsea & Westminster TEN management protocol [corrected] // Br J Dermatol. — 2010. — № 4. — Р. 860–865. ссылка
- Берман Р. Э., Клигман Р. М., Дженсон Х. Б. Педиатрия по Нельсону. Том 3. — 17-е издание. — М.: Рид Элсивер, 2009. — С. 1004–1005.
- Finkelstein Y., Macdonald Е. М., Li P. et al. Recurrence and mortality following severe cutaneous adverse reactions // JAMA. — 2014. — № 21. — Р. 2231–2232. ссылка
- Bastuji-Garin S., Fouchard N., Bertocchi M. et al. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis // J Invest Dermatol. — 2000. — № 2. — Р. 149–153. ссылка
- MSD Manuals. Stevens-Johnson Syndrome (SJS) and Toxic Epidermal Necrolysis (TEN). — 2020.
- Ball R., Ball L. K., Wise R. P. Stevens — Johnson syndrome and toxic epidermal necrolysis after vaccination: reports to the vaccine adverse event reporting system // Pediatr Infect Dis J. — 2001. — № 2. — Р. 219–223. ссылка
- Grammer L. C., Greenberger P. A. Patterson’s Allergic Diseases (Allergic Diseases: Diagnosis & Management). — Lippincott Williams & Wilkins, 2009. — 713 p.
- Верткин А. Л., Дадыкина А. В. Синдром Стивенса–Джонсона // Лечащий врач. — 2006. — № 4. — С. 79–82.
- Hamilton R., Scorer M., Jones G. et al. Stevens — Johnson syndrome and toxic epidermal necrolysis // Pharmaceutical Journal. — 2019. — № 5.
- Balai M., Meena M., Mittal A. et al. Cyclosporine in Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: Experience from a Tertiary Care Centre of South Rajasthan // Indian Dermatol Online J. — 2021. — № 1. — Р. 116–122. ссылка
- Foster С. S. What is the mortality rate for Stevens-Johnson syndrome (SJS) and which complications are associated with increased mortality // Medscape. — 2019.
- Maity S., Banerjee I., Mustafi S. et al. Nikolsky’s sign: A pathognomic boon // Journal of Family Medicine and Primary Care. — 2020. — № 2. — Р. 526–530. ссылка