Первичный дефицит антител (primary antibody deficiencies) — это сбой в работе иммунной системы, при котором нарушается процесс образования защитных белков (антител, или иммуноглобулинов) в ответ на перенесённую инфекцию или вакцинацию. Проявляется повторяющимися тяжёлыми инфекциями, часто с развитием осложнений. Эта патология относится к первичным иммунодефицитам (ПИД), их ещё называют генетическими, или врождёнными.
Синоним: первичные иммунодефициты с преимущественной недостаточностью синтеза антител.
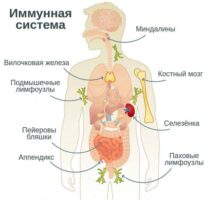
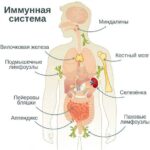
Все ПИД делятся в зависимости от того, какое звено иммунитета страдает: клеточное (Т-клетки), гуморальное (В-клетки) или врождённый иммунитет, а бывают и смешанные, комбинированные формы . Дефицит антител относится к нарушениям гуморального иммунитета, так как именно В-клетки вырабатывают антитела.
ПИД с недостаточностью антител очень различны по клиническим проявлениям, возрасту начала заболевания и глубине изменений в показателях состояния иммунной системы.
В эту группу ПИД входят:
- общая вариабельная иммунная недостаточность (ОВИН);
- Х-сцепленная агаммаглобулинемия;
- аутосомно-рецессивная агаммаглобулинемия;
- селективный IgA-дефицит;
- нарушение синтеза специфических антител;
- транзиторная младенческая гипогаммаглобулинемия;
- дефицит подклассов IgG и другие более редкие иммунодефициты .
Распространённость
ПИД одинаково часто встречается у людей всех рас . Нарушение синтеза антител является наиболее распространённым типом ПИД и встречается в 60 % случаев .
В Российском регистре пациентов с ПИД преимущественное нарушение синтеза антител к 2021 году диагностировано у 782 пациентов, что составляет 30 % от общего числа пациентов с ПИД .
Частота встречаемости зависит от формы:
- ОВИН (общая вариабельная иммунная недостаточность) — точных данных о распространённости нет, но, по разным оценкам, она составляет один случай на 10–100 тысяч населения. Это самая частая форма ПИД из тех, что сопровождаются симптомами .
- Агаммаглобулинемия — один случай на 100–200 тысяч населения .
- Селективный IgA-дефицит — один случай на 700 человек. Однако в зависимости от популяции распространённость разная: от 1:134 до 1:18 500 . Это наиболее частая форма ПИД с нарушением синтеза антител. В отличие от ОВИН, чаще всего никак себя не проявляет, т. е. протекает бессимптомно.
Распространённость других форм ПИД с нарушением синтеза антител неизвестна.
Причины и факторы риска ПИД с недостаточностью антител
Причина ПИД — мутации генов, которые передаются по наследству или возникают спонтанно в здоровой семье (такие случаи называют de novo). Тип наследования может быть разным:
- Х-сцепленное — это наследование, сцепленное с полом, при котором поломанный ген расположен на половой Х-хромосоме. Болезнь проявляется только в том случае, если нет другой Х-хромосомы с нормальной копией того же гена, т. е. болеют только мальчики, так как у них только одна Х-хромосома. Девочки являются носительницами мутантного гена. Большинство мутаций являются семейными, но иногда возникают de novo.
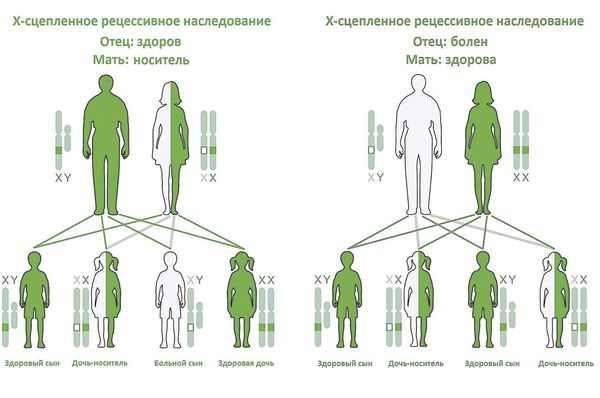
Х-сцепленное наследование
- Аутосомно-рецессивное — болезнь проявляется, если мутация наследуется от обоих родителей, т. е. если повреждены обе копии генов, которые ребёнок получает от родителей. Встречается в 15 % случаев .
- Аутосомно-доминантное — болезнь проявляется, если у человека есть хотя бы один дефектный ген, причём этот ген не содержится в половых (Х и Y) хромосомах.
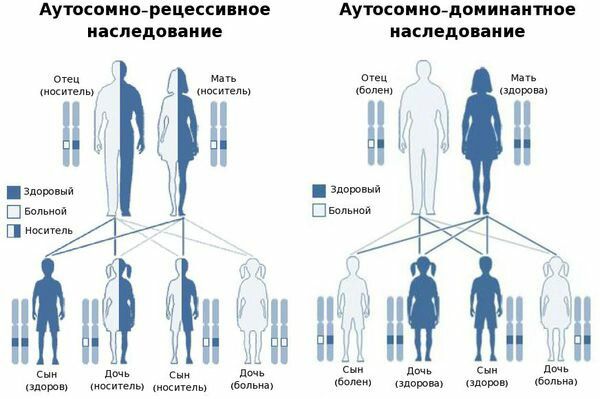
Аутосомно-рецессивное и аутосомно-доминантное наследование
Факторы риска:
- Наличие в семье больных ПИД.
- Женщина (мать) носительница мутантного гена.
- Синдром Мора — Транебьерга, или синдром глухоты-дистонии. Это крайне редкое наследственное заболевание, описанное главным образом у представителей родственных семей в Норвегии. Синдром проявляется в раннем детстве потерей слуха, затем нарушается координация движений, ухудшается зрение и прогрессирует снижение интеллекта. Эта болезнь иногда дополняет Х-сцепленную агаммаглобулинемию .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы агаммаглобулинемии и других первичных дефицитов антител
У ПИД с недостаточностью антител нет каких-то специфических симптомов. Он проявляется постоянно повторяющейся, тяжёлой инфекцией носоглотки, ушей, лёгких, желудочно-кишечного тракта или суставов. Воспаление обычно переходит в хроническую форму и часто сопровождается осложнениями.
Такой ПИД может проявиться в любом возрасте. У младенцев инфекции обычно начинаются после прекращения грудного вскармливания, так как ребёнок перестаёт получать защитные антитела из грудного молока. У 50 % детей серьёзные инфекции (пневмонии, отиты, синуситы и др.) развиваются ко второму году жизни. Но эти заболевания могут начаться и во взрослом, и даже в пожилом возрасте .
Инфекционные проявления:
- Частые бактериальные инфекции: более семи гнойных отитов или более двух гнойных синуситов за год.
- Устойчивость инфекций к антибиотикам, из-за чего лечение может длиться более двух месяцев.
- Тяжёлые, опасные для жизни инфекции, распространившиеся по организму: менингит (воспаление оболочек головного мозга), остеомиелит (воспаление костей), сепсис (инфекционное заражение крови).
- Рецидивирующие глубокие абсцессы (гнойники) кожи и мягких тканей.
- Осложнения после вакцинации ослабленными живыми вакцинами (БЦЖ, полиомиелит).
Неинфекционные проявления:
- Увеличение лимфатических узлов, селезёнки или печени.
- Частый жидкий стул (диарея). Его причиной могут стать не только инфекции, но и различные неинфекционные (воспалительные и аутоиммунные) процессы.
- Возможны аутоиммунные проявления со стороны крови, например цитопении — дефицит одного или нескольких видов клеток крови. Снижение уровня тромбоцитов (тромбоцитопения) приводит к повышенной кровоточивости: появлению синяков, замедленной остановке кровотечения. При снижении нейтрофилов (нейтропении) растёт риск инфекций. Уменьшение эритроцитов в крови нарушает транспорт кислорода, что становится причиной гипоксии — кислородного голодания организма, при котором появляется бледность, слабость, вялость, головные боли, нарушается работа сердца и сосудистой системы.
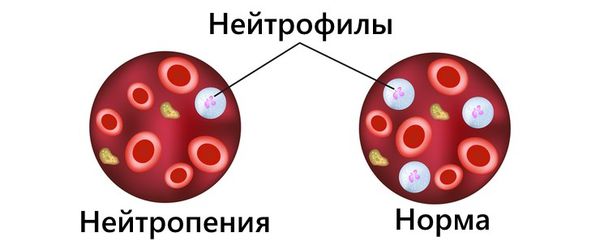
Нейтропения
- Гранулематозное воспаление в органах — появление неинфекционных узелков в лёгких, лимфатических узлах и селезёнке. Патология сопровождается неспецифическими проявлениями: нарушением самочувствия, повышением температуры тела, болями в суставах в зависимости от локализации, длительным кашлем, болями в животе, увеличением лимфатических узлов. Эта группа заболеваний устанавливается после тщательно проведённой диагностики: КТ, МРТ, биопсии.
Патогенез агаммаглобулинемии и других первичных дефицитов антител
При рождении человек расстаётся с привычными комфортными условиями в утробе матери. С этого момента начинается период знакомства с богатым миром микроорганизмов. Первая встреча с ними приводит к развитию заболевания и запускает ответ иммунитета с формированием памяти, что надолго, а иногда и пожизненно, защищает человека от развития болезни при повторном контакте с инфекцией.
Рассмотрим подробнее, что происходит, если чужеродное вещество — антиген (например, бактерия) попадает в организм. Сначала антигенпрезентирующие клетки знакомятся с антигеном и передают информацию специальным клеткам крови — В-лимфоцитам. Эти клетки активируются и обучаются быть клетками памяти и клетками-плазмоцитами. Клетки памяти «запоминают» антиген, что позволяет иммунной системе защищать человека от повторного заражения. Плазмоциты вырабатывают защитные белки — антитела (иммуноглобулины), которые нейтрализуют клетки бактерий, грибов, паразитов, вирусов, а также яды и другие чужеродные вещества.
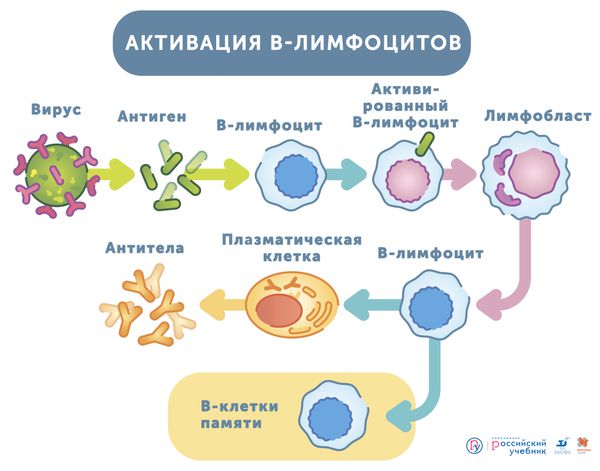
Активация В-лимфоцитов [45]
По такому же принципу работает и вакцинация. После введения вакцины, как и после болезни, вырабатываются антитела, поэтому риск заболеть намного ниже, а в случае заражения можно рассчитывать на лёгкое течение болезни без осложнений .
Против каждого антигена, с которым встречается человек, вырабатывается особый иммуноглобулин, поэтому их очень много. Связываясь с «чужаками», антитела могут либо сами их обезвредить, либо привлечь других участников иммунитета.
В нашем организме есть следующие группы антител:
- Иммуноглобулин G (IgG) — основной защитник от микроорганизмов (вирусов и бактерий), единственный из антител нейтрализатор токсинов (ядов, бактерий). Составляет около 75 % от всех иммуноглобулинов.
- Иммуноглобулин М (IgМ) — образуется первым в ответ на появление антигена в организме. Маркер острого инфекционного процесса. Составляет 5–10 % всех иммуноглобулинов.
- Иммуноглобулин А (IgА) — основной участник местного иммунитета. Находясь в составе секрета желёз слизистых оболочек (слюне, пищеварительном соке, выделениях слизистой носа и молочной железы), не даёт бактерии прикрепиться к слизистой и активирует её уничтожение.
- Иммуноглобулин E (IgE) — играет роль в формировании аллергических реакции, а также в защите от паразитарных возбудителей. Его уровень в норме очень низкий.
- Иммуноглобулин D (IgD) — участвует в процессах иммунного ответа и, вероятно, повышает активность других иммуноглобулинов. Это наименее изученный класс антител .
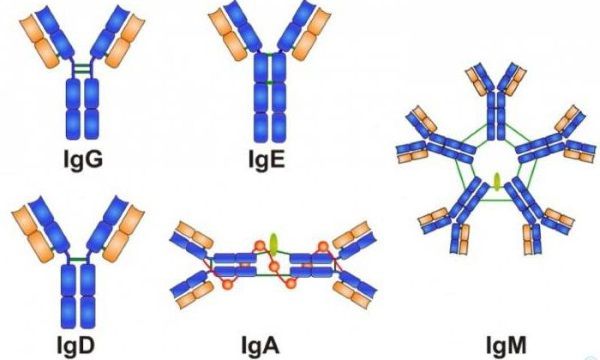
Группы антител
Мутация генов угнетает созревание и обучение В-лимфоцитов и плазматических клеток, которые образуют антитела. Это и приводит к первичному иммунодефициту с отсутствием или очень низким остаточным количеством иммуноглобулинов в крови. Последствиями такой поломки будет повышенная восприимчивость к инфекциям и неспособность вырабатывать антитела после введения вакцин .
Классификация и стадии развития агаммаглобулинемии и других первичных дефицитов антител
Международная классификация болезней 10-го пересмотра (МКБ-10):
- D80 Иммунодефициты с преимущественной недостаточностью антител.
- D80.0 Наследственная гипогаммаглобулинемия.
- D80.1 Несемейная гипогаммаглобулинемия.
- D80.2 Избирательный дефицит иммуноглобулина A (IgA).
- D80.3 Избирательный дефицит подклассов иммуноглобулина G (IgG).
- D80.4 Избирательный дефицит иммуноглобулина M (IgM).
- D80.5 Иммунодефицит с повышенным содержанием иммуноглобулина M (IgM).
- D80.6 Недостаточность антител с близким к норме уровнем иммуноглобулинов или с гипериммуноглобулинемией.
- D80.7 Преходящая гипогаммаглобулинемия детей.
- D80.8 Другие иммунодефициты с преимущественным дефектом антител.
- D80.9 Иммунодефицит с преимущественным дефектом антител неуточнённый.
- D83 Общий вариабельный иммунодефицит (ОВИН).
- D83.0 Общий вариабельный иммунодефицит с преобладающими отклонениями в количестве и функциональной активности B-клеток.
- D83.1 Общий вариабельный иммунодефицит с преобладанием нарушений иммунорегуляторных T-клеток.
- D83.2 Общий вариабельный иммунодефицит с аутоантителами к B- или T-клеткам.
- D83.8 Другие общие вариабельные иммунодефициты.
- D83.9 Общий вариабельный иммунодефицит неуточнённый.
Наиболее распространённые формы ПИД с недостаточностью антител
Агаммаглобулинемия
Х-сцепленную агаммаглобулинемию (XLA) ещё называют болезнью Брутона по фамилии американского педиатра и иммунолога Огдена Брутона, который впервые описал эту патологию в 1952 году. На долю XLA приходится около 85 % известных случаев агаммаглобулинемии.
Причина — генетическая мутация гена ВТК. Этот ген кодирует В-клеточную, или Брутоновскую, тирозинкиназу, которая играет важную роль в созревании В-лимфоцитов. Поломанный ген расположен на половой Х-хромосоме. Болезнь проявляется только у мальчиков, девочки являются носительницами мутантного гена .
При типичном XLA зрелые B-лимфоциты и иммуноглобулины в крови полностью отсутствуют. В этом случае ребёнок с первых месяцев жизни страдает от тяжёлых повторяющихся бактериальных инфекций, отстаёт в росте и наборе веса. Со временем появляются осложнения: глухота из-за неоднократных отитов, бронхоэктазы (расширение и разрушение стенки бронхов) как следствие множественных пневмоний, деформация суставов из-за артритов.
Атипичный XLA диагностируют, когда зрелые B-лимфоциты и иммуноглобулины есть, но их уровень ниже нормы. Атипичный тип встречается редко и протекает без тяжёлых бактериальных инфекций. Иногда до зрелого возраста (до 20–35 лет) болезнь никак не проявляется, поэтому её часто диагностируют во взрослом возрасте.
В 15 % встречается аутосомно-рецессивная агаммаглобулинемия . Такая патология не связана с мутациями в гене BTK. Симптомы и лабораторные признаки аутосомно-рецессивной агаммаглобулинемии примерно такие же, как и при XLA.
Общая вариабельная иммунная недостаточность (ОВИН)
Это один из самых распространённых ПИД с недостаточностью антител. Генетические мутации являются причиной патологии примерно в 10–20 % случаев. У остальных 80–90 % причина неизвестна . Возможно, какая-то вирусная инфекция вызывает развитие заболевания у предрасположенных лиц.
Болезнь может проявиться в любом возрасте. Многие авторы выделяют два пика старта ОВИН: 2–5 лет и 18–25 лет .
Инфекционные проявления при ОВИН, такие же, как и при ХLA. Также характерен широкий спектр неинфекционных проявлений, связанных с нарушенной работой иммунной системы:
- Увеличение печени, селезёнки или лимфатических узлов — выявляются у 40–60 % пациентов.
- Интерстициальная болезнь лёгких (ИБЛ) и гранулематозное поражение.
- Поражение желудочно-кишечного тракта — встречается у 20 % больных.
- Цитопении в анализах крови — выявляются в 10–29 % случаев. Часто они являются первым клиническим проявлением заболевания.
- Злокачественные новообразования, особенно лимфомы. У пациентов с ОВИН повышен риск их развития .
Селективный (изолированный) IgA-дефицит
Практически у 2/3 пациентов протекает бессимптомно. Селективный IgA-дефицит может возникать спонтанно в здоровой семье, но также может передаваться по наследству . Обычно характерны частые, но нетяжёлые инфекции. У пациентов с селективным дефицитом IgA могут также быть сопутствующие заболевания ЖКТ, аутоиммунные и аллергические заболевания.
Дефицит подклассов IgG
Причина неизвестна. Для дефицита подклассов IgG характерны синуситы, отиты, бронхиты, при этом пневмонии и менингиты развиваются реже. Отмечается склонность к аллергическим заболеваниям. Со временем возможно развитие ОВИН .
Транзиторная младенческая гипогаммаглобулинемия
Это временное состояние, когда в крови младенцев временно снижается количество антител. Возникает после прекращения грудного вскармливания, когда материнские антитела уже израсходованы, а собственные ещё не выработались. Заболевание может протекать бессимптомно, но у небольшого числа детей развиваются инфекции: синусит, пневмония, менингит и др. Также появляются грибковые инфекции, например кандидоз. В отличие от других форм ПИД с недостаточностью антител, при транзиторной младенческой гипогаммаглобулинемии после вакцинации, например от столбняка и дифтерии, вырабатываются полноценные защитные антитела . Лечение не требуется, все дети выздоравливают.
Осложнения агаммаглобулинемии и других первичных дефицитов антител
Инфекционные осложнения: остеомиелит, бактериальный менингит, сепсис.
Дерматомиозит и хронический менингоэнцефалит. При ПИД они часто осложняют течение энтеровирусных инфекций, хотя у людей без ПИД они обычно протекают легко. Дерматомиозит — это тяжёлое прогрессирующее системное заболевание соединительной ткани и мышц с нарастающей слабостью в руках и ногах, отёком и покраснением, часто осложняется гнойной инфекцией. Хронический менингоэнцефалит — воспаление оболочек и вещества головного мозга, которое может затронуть спинной мозг и вызвать паралич.
Желудочно-кишечные проявления. Болезни ЖКТ встречаются у 35 % пациентов, в том числе рецидивирующие желудочно-кишечные инфекции (сальмонеллёз, лямблиоз, хеликобактерная инфекция и др.) и воспалительные заболевания кишечника (колит, энтерит) .
Злокачественные новообразования. ПИД с недостаточностью антител входит в число первичных иммунодефицитов с повышенным риском рака, например лимфомы, лейкемии, рака желудка и толстой кишки. Риск развития лимфомы существенно увеличивается с возрастом . Лимфома сопровождается увеличением лимфатических узлов (паховых, шейных, подмышечных и других групп), так как в них происходит бесконтрольное накопление «опухолевых» лимфоцитов. Часто повышается температура тела, появляется слабость. Могут поражаться различные внутренние органы .
Серьёзные поражения дыхательной системы:
- Бронхоэктазы — расширение и разрушение стенки бронхов с появлением рубцов и образованием вместо функционирующей лёгочной ткани «мешков», где может скапливаться мокрота и гной. Состояние сопровождается постоянным кашлем, отхождением гнойной мокроты с неприятным запахом. Бывает кровохарканье и даже лёгочное кровотечение. Со временем эти изменения в лёгких приводят к дыхательной недостаточности и гипоксии. У детей страдает физическое развитие, они отстают в росте и весе. Бронхоэктазы часто прогрессируют и не поддаются лечению, поэтому являются основной причиной смерти.
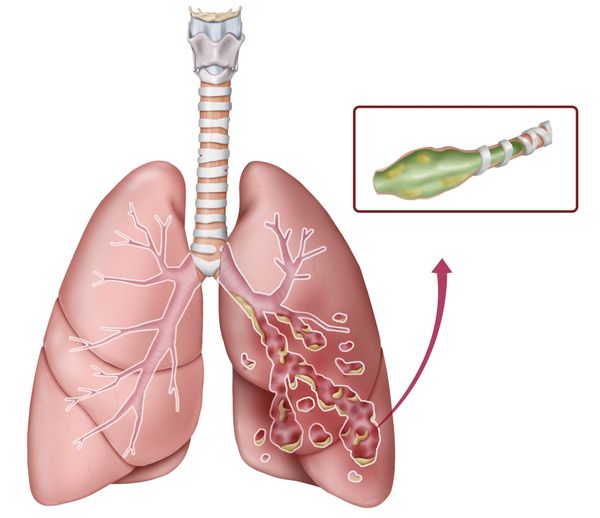
Бронхоэктазы
- Интерстициальная лёгочная болезнь — воспаление альвеол (мельчайших лёгочных пузырьков, которыми заканчиваются бронхи), лёгочных кровеносных и лимфатических сосудов, не связанное с инфекцией. Характерный симптом — одышка, являющаяся отражением лёгочной недостаточности.
Диагностика агаммаглобулинемии и других первичных дефицитов антител
ПИД — это тяжёлое, но не очень частое состояние. Заподозрить его можно по симптомам, которые изображены на рисунке.

Настораживающие признаки первичных иммунодефицитов[18]
При наличии двух и более признаков из 12 необходима консультация врача-иммунолога .
Сбор анамнеза
На приёме доктор задаст вопросы, чтобы предположить диагноз и определить спектр обследования:
- В каком возрасте начались болезни, как часто повторяются. Насколько тяжело и как долго протекают. Как часто требовались антибиотики.
- Есть ли ПИД у других членов семьи. Были ли у родственников ранние, частые бактериальные инфекции или ранние смерти .
Осмотр
- Врач оценит рост и вес, чтобы определить, соответствуют ли показатели возрасту или есть дефицит. Для большинства больных с нарушением синтеза антител характерно нормальное физическое развитие, но при раннем начале ПИД и отсутствии лечения дети могут отставать в росте и весе. У пациентов с тяжёлым диарейным синдромом тоже часто есть дефицит веса.
- При осмотре кожи врач может заметить проявления бактериальной инфекции (гнойнички, язвочки и др.).
- Доктор проверит слух и зрение.
- При обследовании лимфатической системы могут быть обнаружены недоразвитые или отсутствующие аденоиды, миндалины и лимфатические узлы.
Лабораторная диагностика
- Клинический анализ крови — выявляются различные цитопении.
- Биохимический анализ крови — показывает снижение общего белка в крови, иногда повышение уровня СРБ, что указывает на воспаление. Также проводятся анализы, чтобы оценить работу почек и печени. Например при поражении печени (гепатите) увеличивается уровень АЛТ, АСТ и билирубина, в моче появляется белок (протеинурия) и кровь (гематурия). Повышение креатинина сыворотки крови и снижение скорости клубочковой фильтрации будет указывать на повреждение почек.
- Анализ крови на иммуноглобулины G, A и M — выявляется снижение их уровня.
Лабораторная диагностика ПИД с нарушением синтеза антител
| Показатели | Норма | ХLA и другие агаммаглобулинемии | Селективный дефицит IgA | Гипер-IgM | ОВИН |
|---|---|---|---|---|---|
| IgA (мг/дл) | 100–350 | < 20 | < 7 | < 7 | Снижение |
| IgM (мг/дл) | 80–250 | < 20 | Норма | > 300 | Снижение или норма |
| IgG (мг/дл) | 900–1800 | < 200 | Норма | Снижение | < 450–500 мг/дл (у взрослых), снижение на 2 стандартных отклонения от возрастной нормы (у детей) |
| В-клетки | 5–19 % | < 1 % | Норма | Норма | Изменения вариабельны (от нормальных значений до резкого снижения < 1 %) |
| Т-клетки | 55–80 % | Норма | Норма | Вариабельно | Вариабельно |
Чтобы исключить комбинированные формы ПИД, при которых нарушается не только гуморальный, но и клеточный иммунитет, в некоторых случаях рекомендуется дополнительно оценить уровень CD3+, CD4+, CD8+, CD16+/56+ лимфоцитов в крови. Такое иммунологическое исследование проводится:
- если уровень IgG в крови ниже двух стандартных отклонений от возрастной нормы у детей и ниже 450 мг/дл у взрослых;
- или если уровень IgG в крови ниже 100 мг/дл в сочетании с уровнем IgM ниже 20 мг/дл и уровнем IgA ниже 10 мг/дл при уровне периферических CD19+ В-клеток ниже 2 % .
Всем больным с подозрением на ПИД целесообразно проводить молекулярно-генетическое тестирование, так как выявление и подтверждение дефекта определяет прогноз и тактику лечения.
При подозрении на ПИД в качестве диагностики могут проводить вакцинацию против столбняка, гемофильной палочки, пневмококка, дифтерии и менингококковой инфекции. При селективном (избирательном) дефиците антител после введения вакцины антитела не обнаруживаются.
По показаниям проводятся исследования: УЗИ, ФГДС, КТ, МРТ, рентген и другие. Они могут потребоваться, чтобы исключить хроническую инфекционную патологию, например синусит, пневмонию и др.
При необходимости проводятся консультации специалистов: пульмонолога, гематолога, онколога, гастроэнтеролога, ревматолога или отоларинголога.
Если диагноз подтверждается, врач вносит данные пациента в регистр. Такие регистры во всём мире являются единственным способом сбора и накопления информации по редким заболеваниям. Есть регистр Европейского общества ПИДС, он существует с 2004 года и содержит данные более чем о 28 тысячах пациентов. В России с помощью Национальной ассоциации экспертов в области ПИД (НАЭПИД) в 2017 году создан российский регистр, в котором к 2022 году внесены данные около 3500 пациентов. Если учитывать средние показатели распространённости ПИД в мире, то в России таких пациентов должно быть не менее 12–14 тысяч. Это значит, что большинство пациентов всё-таки остаются не диагностированы .
Дифференциальная диагностика
ПИД с недостаточностью антител нужно отличить от других патологий, при которых также снижен уровень иммуноглобулинов, например от вторичного (приобретённого) иммунодефицита. При этой патологии работа иммунитета нарушается под воздействием разнообразных факторов, таких как:
- недоедание (голодание) и строгое вегетарианство т. е. веганство;
- тяжёлые инфекции, в том числе ВИЧ-инфекция;
- приём иммунодепрессантов для угнетения иммунной системы;
- злокачественные опухоли .
Также патологию нужно отличать от других ПИД с похожими симптомами, но не связанных с нарушением выработки антител.
Лечение агаммаглобулинемии и других первичных дефицитов антител
Основные направления в лечении больных ПИД с недостаточностью антител:
- Заместительная терапия донорскими иммуноглобулинами.
- Профилактика и/или терапия инфекционных проявлений.
- Иммуносупрессивная терапия.
- Трансплантация гематопоэтических стволовых клеток.
- Хирургическое лечение.
1. Заместительная терапия донорскими иммуноглобулинами IgG. Терапия Иммуноглобулином человека нормальным должна проводиться всем пациентам со значительным нарушением выработки антител, включая агаммаглобулинемию. Цели заместительной терапии — достичь минимального уровня IgG у конкретного пациента, что предотвращает инфекции. Препарат вводится внутривенно или подкожно.
Терапия внутривенным иммуноглобулином используется в режиме насыщения — 0,6–0,8 г/кг массы тела один раз в 3–4 недели. Дозировка подбирается индивидуально в соответствии с тяжестью ПИД и эффектом от лечения.
Рекомендуемая доза подкожного иммуноглобулина 100–200 мг/кг каждую неделю. Показания к подкожному введению: системные эффекты, затруднённый венозный доступ, большое расстояние до больницы, предпочтения пациента.
Эффективность подкожного и внутривенного введения сопоставима между собой, но при подкожном введении отмечается меньше побочных эффектов и требуются более низкие дозы, чтобы достичь аналогичных минимальных уровней IgG. Кроме того, этот метод удобнее, так как пациенты могут вводить препарат в домашних условиях .
Как и где должен вводится препарат, определяет только врач, основываясь на клинических проявлениях болезни, опыте пациента и других обстоятельствах. Препарат выводится из организма в среднем через 21 день, поэтому нежелательно пропускать инъекции или удлинять интервал между ними.
Показатели эффективности терапии:
- Достижение контроля над инфекционными проявлениями. Это значит, что инфекционные заболевания возникают реже, протекают быстро и без осложнений.
- Достижение цели, когда уровень иммуноглобулина G перед введением препарата не ниже 800 мг/дл.
Побочные реакции на лечение обычно незначительны, могут включать головную и мышечную боль, озноб, недомогание, боль в спине и суставах, утомляемость, беспокойство, сыпь, тошноту, рвоту, покалывание, изменения артериального давления. Такие реакции можно уменьшить, если перед основным лечением принимать нестероидные противовоспалительные препараты, Ацетаминофен, Дифенгидрамин или антигистаминные препараты и/или Гидрокортизон по назначению врача.
Серьёзные побочные реакции встречаются редко и включают одышку, боль в груди, анафилаксию, острую почечную недостаточность, тромбоз глубоких вен или лёгочную эмболию, инфаркт миокарда, инсульт или асептический менингит .
Заместительную терапию нужно проводить пожизненно.
2. Профилактика и/или терапия инфекционных проявлений. В дополнение к терапии иммуноглобулином часто назначается долгосрочная профилактическая антибиотикотерапия, чтобы предотвратить или пролечить повторные инфекций у пациентов с агаммаглобулинемией .
Курсы антибиотиков у людей с ПИД обычно длятся от нескольких недель до нескольких месяцев. Дозировки антибиотиков подбираются согласно рекомендациям по возрасту и весу пациента. Обычно используют такие антибиотики, как цефалоспорины, аминогликозиды, пенициллиновый ряд, карбапенемы и сульфаниламиды.
3. Иммуносупрессивная терапия. Может назначаться при воспалительных и/или аутоиммунных осложнениях. Предполагает приём лекарств, которые подавляют нежелательные реакции иммунитета.
4. Трансплантация гематопоэтических стволовых клеток. В мировой литературе есть данные, что такая трансплантация проводится у пациентов с нарушением синтеза антител (ОВИН) при развитии злокачественной опухоли или тяжёлой аутоиммунной патологии, устойчивой к классической терапии .
5. Хирургическое лечение. Проводится при осложнениях ПИД: лимфаденитах, абсцессах печени, почек, кожи, парапроктитах и др.
Показания для госпитализации
Плановая госпитализация проводится, когда необходимо:
- первично установить диагноз при наличии симптомов, характерных для ПИД;
- провести заместительную терапию внутривенными иммуноглобулинами;
- пролечить обострение рецидивирующих гнойно-воспалительных заболеваний дыхательной системы, кожи или ЛОР-органов;
- пролечить аутоиммунные осложнения или онкозаболевания на фоне ПИД.
Показания для экстренной госпитализации:
- Состояния, угрожающие жизни и требующие экстренного оказания медицинской помощи. К таким состояниям относится острое жизнеугрожающее нарушение работы органов: сердечно-сосудистая, дыхательная, почечная, печёночная недостаточность.
Существует программа Consulting Immunologist, созданная Фондом иммунодефицитов (США), где можно получить бесплатные врачебные консультации для пациентов с первичным иммунодефицитом .
Прогноз. Профилактика
Прогноз в целом благоприятный при ранней диагностике (при первых проявлениях или до них), лечении антибиотиками и заместительной терапии иммуноглобулинами. Исследования показывают, что заболеваемость пневмонией прогрессивно снижается с повышением минимальных уровней IgG .
Выживаемость значительно улучшилась в последние десятилетия и на сегодняшний день составляет около 48 %. Однако эффективность лечения по-прежнему ограничена, так как нет препаратов, содержащих IgA и IgM.
Беременность и роды при ПИД не протиповоказаны, но будущая мама должна регулярно наблюдаться у врача и получать адекватную заместительную терапию.
Профилактика
Первичная профилактика. Рекомендуется генетическое консультирование, чтобы выявить носителей генов и больных ПИД в семье и оценить риск болезни у потомства.
Пренатальное генетическое тестирование (до рождения) может быть рекомендовано, если у кого-либо в семье установлен диагноз ПИД или кто-то является носителем мутантного гена. Чтобы провести такое тестирование, изучают клетки пуповинной крови и околоплодных вод, а также ворсины хориона . Такое раннее выявление заболевания и лечение могут улучшить прогноз и избежать осложнений, например после введения в роддоме живой вакцины против туберкулёза (БЦЖ-М). Введение такой вакцины ребёнку с дефицитом антител приведёт к серьёзным последствиям и, возможно, даже гибели младенца.
Во многих странах (США, Испании и др.) необследованные семьи сразу в роддоме могут сделать скрининг ПИД, чтобы узнать, есть ли у ребёнка это заболевание. Скрининг подразумевает определение TREC и КREC в крови. Материалом для исследования являются сухие пятна крови ребёнка.

Скрининг новорождённых
В России тоже рассматривают внедрение такой программы. При этом некоторые частные клиники в нашей стране уже сейчас делают такой анализ .
Вторичная профилактика проводится, чтобы избежать осложнений. Для этого необходимо:
- Как можно раньше выявить болезнь и начать заместительную терапию иммунодефицита.
- Вакцинировать больных ПИД с нарушением синтеза антител неживыми вакцинами: против вируса гриппа (ежегодно), гемофильной палочки и пневмококка. Запрещено вводить живые вакцины: против кори, краснухи, паротита, БЦЖ, полиомиелита, ветряной оспы и ротавирусной инфекции. Это может вызвать опасные для жизни осложнения, например, вакцина против полиомиелита, которую нужно закапывать в рот, может стать причиной вакцин-ассоциированного полиомиелита.
- Вакцинировать семью и окружение пациентов с ПИД в соответствии с Национальным календарём прививок РФ, чтобы у больных было меньше рисков заразиться какой-либо инфекцией. В таких случаях также предпочтительно использовать неживые вакцины.
- Соблюдать правила личной гигиены и меры предосторожности против инфекции, такие как мытьё рук и ношение масок.
- Пациентам, получающим заместительную терапию иммуноглобулином, регулярно (минимум каждые 6–12 месяцев) контролировать минимальный уровень IgG, количества клеток крови и делать биохимический анализ сыворотки.
Список литературы
- Российская ассоциация аллергологов и клинических иммунологов, Национальная ассоциация экспертов в области первичных иммунодефицитов. Первичные иммунодефициты с преимущественной недостаточностью синтеза антител: клинические рекомендации. — М., 2021. — 60 с.
- Спикетт Г. Клиническая иммунология и аллергология / пер. с англ. под ред. Н. И. Ильиной. — М.: ГОЭТАР-Медиа, 2019. — 824 с.
- Aghamohammadi A. et al. Primary Immunodeficiency Diseases. Definition, Diagnosis, and Management. — Berlin, Heidelberg: Springer, 2017. — P. 183–244.
- Grimbacher B. The European Society for Immunodeficiencies (ESID) registry 2014 // Clin Exp Immunol. — 2014. — Vol. 178 (Suppl 1). — Р. 18–20. ссылка
- Bonilla F. A., Barlan I., Chapel H. et al. International Consensus Document (ICON): Common Variable Immunodeficiency Disorders // J Allergy Clin Immunol Pract. — 2016. — Vol. 4, № 1. — Р. 38–59. ссылка
- Латышева Е. А. Первичные иммунодефициты у взрослых. Преимущественное нарушение синтеза антител // Терапия. — 2018. — № 7–8. — С. 119–124.
- Smith C. E., Berglöf A. X-Linked Agammaglobulinemia // GeneReviews. — 2001.ссылка
- Jackson K. M., Nazar A. M. Breastfeeding, the immune response, and long-term health // J Am Osteopath Assoc. — 2006. — Vol. 106, № 4. — Р. 203–207.ссылка
- Gemayel K. T., Litman G. W., Sriaroon P. Autosomal recessive agammaglobulinemia associated with an IGLL1 gene missense mutation // Ann Allergy Asthma Immunol. — 2016. — Vol. 117, № 4. — Р. 439–441. ссылка
- Azizi G., Bagheri Y., Tavakol M. et al. The Clinical and Immunological Features of Patients with Primary Antibody Deficiencies // Endocr Metab Immune Disord Drug Targets. — 2018. — Vol. 18, № 5. — Р. 537–545. ссылка
- Калинина Н. М., Кетлинский С. А., Оковитый С. В., Шуленин С. Н. Заболевания иммунной системы. Диагностика и фармакотерапия. — М.: Эксмо, 2008. — С. 132–137.
- Abolhassani H. et al. A review on guidelines for management and treatment of common variable immunodeficiency // Expert Rev. Clin. Immunol. — 2013. — Vol. 9, № 6. — P. 561–575. ссылка
- Khokar A., Gupta S. Clinical and Immunological Features of 78 Adult Patients with Primary Selective IgG Subclass Deficiencies // Arch Immunol Ther Exp (Warsz). — 2019. — Vol. 67, № 5. — Р. 325–334. ссылка
- Rich R. R., Fleisher T. A., Shearer W. T. et al. Clinical Immunology. Principles and Practice. — 5th Edition. — 2018. — 1392 p.
- Vinuesa C. G., de Lucas C., Cook M. C. Clinical implications of the specialised B cell response to polysaccharide encapsulated pathogens // Postgrad Med J. — 2001. — Vol. 77, № 911. — Р. 562–569. ссылка
- Icard C., Gaspar H. B., Al-Herz W. et al. International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity // J Clin Immunol. — 2018. — Vol. 38, № 1. — Р. 96–128. ссылка
- Vajdic C. M., Mao L., van Leeuwen M. T. et al. Are antibody deficiency disorders associated with a narrower range of cancers than other forms of immunodeficiency? // Blood. — 2010. — Vol. 116, № 8. — Р. 1228–1234. ссылка
- Что такое первичный иммунодефицит? // сайт Благотворительного Фонда «ПОДСОЛНУХ». [Электронный ресурс]. Дата обращения: 18.05.2022.
- Subbarayan A., Colarusso G., Hughes S. M. et al. Clinical features that identify children with primary immunodeficiency diseases // Pediatrics. — 2011. — Vol. 127, № 5. — Р. 810–816. ссылка
- Burns S. ESID diagnostic criteria for PID // European Society for Immunodeficiencies. — 2020.
- Seidel M. G., Kindle G., Gathmann B. et al. The European Society for Immunodeficiencies (ESID) Registry Working Definitions for the Clinical Diagnosis of Inborn Errors of Immunity // J Allergy Clin Immunol Pract. — 2019. — Vol. 7, № 6. — Р. 1763–1770. ссылка
- Locke B. A., Dasu T., Verbsky J. W. Laboratory diagnosis of primary immunodeficiencies. Clin Rev Allergy Immunol. — 2014. — Vol. 46, № 2. — Р. 154–168.ссылка
- Fried A. J., Bonilla F. A. Pathogenesis, Diagnosis, and Management of Primary Antibody Deficiencies and Infections // Clin Microbiol Rev. — 2009. — Vol. 22, № 3. — Р. 396–414. ссылка
- Chinen J., Shearer W. T. Secondary immunodeficiencies, including HIV infection // J Allergy Clin Immunol. — 2010. — Vol. 125 (Suppl 2). — Р. 195–203.ссылка
- Orange J. S., Grossman W. J., Navickis R. J., Wilkes M. M. Impact of trough IgG on pneumonia incidence in primary immunodeficiency: A meta-analysis of clinical studies // Clin Immunol. — 2010. — Vol. 137, № 1. — Р. 21–30.ссылка
- Hoernes M., Seger R., Reichenbach J. Modern management of primary B-cell immunodeficiencies // Pediatr Allergy Immunol. — 2011. — Vol. 22, № 8. — Р. 758–769.ссылка
- Perez E. E., Orange J. S., Bonilla F. et al. Update on the use of immunoglobulin in human disease: A review of evidence // J Allergy Clin Immunol. — 2017. — Vol. 139, № 3S. — Р. S1–S46. ссылка
- Stevens W. W., Peters A. T. Immunodeficiency in chronic sinusitis: recognition and treatment // Am J Rhinol Allergy. — 2015. — Vol 29, № 2. — Р. 115–118.
- IDF Consulting Immunologist Program. Free physician-to-physician consults regarding patients with primary immunodeficiency // Immune Deficiency Foundation. [Электронный ресурс]. Дата обращения: 18.05.2022.
- Suri D., Rawat A., Singh S. X-linked Agammaglobulinemia // Indian J Pediatr. — 2016. — Vol. 83, № 4. — Р. 331–337. ссылка
- Castagnoli R., Delmonte O. M., Calzoni E., Notarangelo L. D. Hematopoietic Stem Cell Transplantation in Primary Immunodeficiency Diseases: Current Status and Future Perspectives // Front Pediatr. — 2019. — № 7. — Р 295.ссылка
- Zhang J., van Oostrom D., Li J., Savelkoul H. F. J. Innate Mechanisms in Selective IgA Deficiency // Front Immunol. — 2021. — № 12. ссылка
- Huq M., Bhatnagar N. K., Hostoffer R. W. Hypogammaglobulinemia // StatPearls. — 2021.ссылка
- Carballo I., Rabuñal N., Alvela L. et al. Factors Influencing Serum Concentrations of Immunoglobulin D in the Adult Population: An Observational Study in Spain. Scand J Immunol. — 2017. — Vol. 85, № 4. — Р. 272–279.ссылка
- Исследование TREC и KREC для диагностики иммунодефицитов (TREC and KREC analysis for immunodeficiency diagnostics) // Invitro. [Электронный ресурс]. Дата обращения: 18.05.2022.
- Mohr J., Mageröy K. Sex-linked deafness of a possibly new type // Acta Genet Stat Med. — 1960. — Vol. 10, № 1–3. — Р. 54–62. ссылка
- Орлов М. А. Синдром Мора — Транеберг // ГЕНОКАРТА. Генетическая энциклопедия. — 2021.
- Bonilla F. A., Khan D. A., Ballas Z. K. et al. Practice parameter for the diagnosis and management of primary immunodeficiency // J Allergy Clin Immunol. — 2015. — Vol. 136, № 5. — Р. 1186–1205.ссылка
- Jesenak M. et al. Pulmonary Manifestations of Primary Immunodeficiency Disorders in Children // Front. Pediatr. — 2014. — Vol. 2. — Р. 77.ссылка
- Латышева Т. В. Пульмунологические проявления у взрослых пациентов с дефектом гуморального звена иммунитета // Терапевтический архив. — 2016. — № 8. — P. 127–134.
- Resnick E. S., Moshier E. L., Godbold J. H., Cunningham-Rundles C. Morbidity and Mortality in Common Variable Immune Deficiency Over 4 Decades // Blood. — 2012. — Vol. 119, № 7. — 1650–1657. ссылка
- Uzzan M. et al. Gastrointestinal Disorders Associated with Common Variable Immune Deficiency (CVID) and Chronic Granulomatous Disease (CGD) // Curr. Gastroenterol. Rep. — 2016. — Vol. 18, № 4. — P. 17.ссылка
- Первичные иммунодефициты преимущественно с недостаточностью антител: клинические рекомендации. — 2018. — 41 с.
- Корсунский И. А. Ранняя диагностика иммунодефицитных состояний у детей: клинические и лабораторные аспекты: дис. … д-ра мед. наук: 14.01.08, 14.03.09. — М., 2019. — 125 с.
- Давыдова О. Зачем нужен иммунитет, и как он работает? Тема для проектной деятельности // сайт корпорации «Российский учебник». — 2018.