Некротический энтероколит (Necrotizing enterocolitis) — это тяжёлое воспаление кишечника, которое сопровождается проникновением бактерий и воздуха в стенку кишки, что приводит к некрозу (отмиранию) поражённой части кишечника.
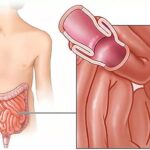
Некротический энтероколит новорождённого
Это одно из наиболее частых неотложных гастроэнтерологических состояний у новорождённых. Болезнь опасна для жизни, но современные методы диагностики и лечения позволяют выявлять и лечить некротический энтероколит (НЭК) на ранних стадиях. Благодаря этому исходы заболевания улучшились — больше младенцев выживает .
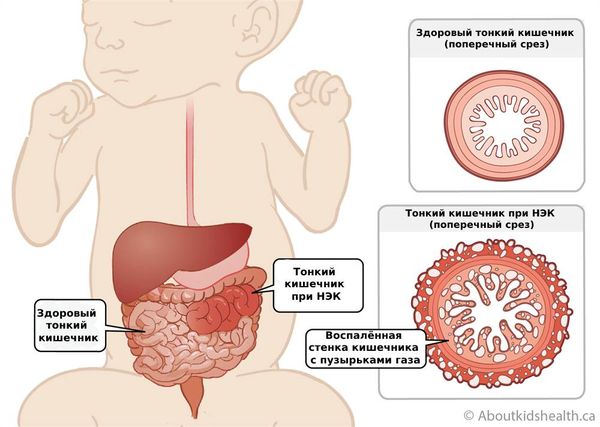
При НЭК сначала повреждается слизистая оболочка кишечника, при прогрессировании процесса некроз распространяется на все слои кишечной стенки. При этом в кишечнике может образоваться сквозное отверстие (перфорация) с развитием жизнеугрожающего осложнения — перитонита (воспаления брюшины).
В типичных случаях НЭК поражает правую половину толстой кишки и конечный отдел подвздошной кишки. Но может быть вовлечён любой отдел тонкого или толстого кишечника, в некоторых случаях поражается весь кишечник.
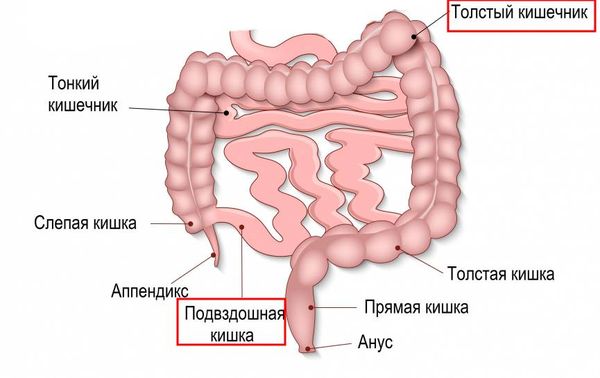
Толстый и тонкий кишечник
Распространённость НЭК
НЭК — болезнь новорождённых детей. Чаще он развивается у недоношенных младенцев с низким весом при рождении. Причём, чем меньше вес ребёнка и срок беременности, тем выше частота НЭК. Поэтому его часто называют «болезнью выживших недоношенных» .
Истинная распространённость неизвестна, но, по разным данным, во всём мире болезнь развивается у 2–7,5 % детей, рождённых до 32-й недели гестации (беременности) .
В США некротический энтероколит 2–3 стадий встречается у 1–3 детей из 1000 . Более 90 % случаев приходится на младенцев с очень низким весом (менее 1500 г), рождённых на сроке менее 32 недель беременности.
По данным отечественных учёных, некротическим энтероколитом заболевают около 5–8 % новорождённых, поступающих в отделения интенсивной терапии по поводу различных неотложных состояний: церебральной ишемии (недостаточного притока крови к мозгу), врождённых пороков сердца (открытого овального окна и др.), бронхолёгочной патологии (пневмонии, синдрома дыхательных расстройств, бронхолёгочной дисплазии) и др.
Около 10 % случаев НЭК приходится на доношенных детей . Обычно это дети, которые не получают грудного молока и имеют сопутствующие заболевания: врождённые пороки сердца, первичные гастроэнтерологические заболевания, сепсис, внутриутробную задержку роста плода и его гипоксию (нехватку кислорода).
У младенцев, рождённых ближе к сроку, НЭК развивается в первую неделю после рождения, у глубоко недоношенных (с весом менее 1500 г) заболевание возникает на четвёртой неделе . Это может быть связано с временем начала кормления грудью, из бутылочки или через зонд (т. е. когда ребёнка начинают кормить энтерально — через желудочно-кишечный тракт). Дело в том, что у глубоко недоношенных детей такое кормление начинается позже, до этого все питательные вещества им вводят внутривенно (парентеральное питание). А НЭК редко развивается у новорождённых, которых ещё не кормили .
Причины и факторы риска развития НЭК
Точная причина НЭК остаётся неизвестной, исследования показывают, что это многофакторная болезнь, т. е. она развивается под воздействием нескольких факторов.
Факторы риска:
- Недоношенность. Причиной может быть патологическое течение беременности.
- Искусственное вскармливание. У детей, которых кормят смесями, НЭК развивается чаще, чем у тех, кто получает грудное молоко .
- Асфиксия в родах. Это состояние, при котором ребёнок сразу после рождения не может самостоятельно дышать.
- Синдром дыхательных расстройств (респираторный дистресс-синдром). Это дыхательная недостаточность у недоношенных детей, вызванная незрелостью лёгких.
- Переохлаждение новорождённого.
- Родовая спинальная и черепно-мозговая травма у ребёнка.
- Врождённые пороки:
- Пороки сердца. Чаще всего НЭК встречается при транспозиции магистральных сосудов, тетраде Фалло, коарктации аорты, широком открытом артериальном протоке, атрезии и стенозе лёгочной артерии и синдроме гипоплазии левых отделов сердца.
- Пороки желудочно-кишечного тракта. Наиболее опасны болезнь Гиршпрунга, гастрошизис, различные виды атрезии кишечника, так как при этих состояниях НЭК обычно поздно диагностируют, что повышает риск осложнений и летального исхода.
- Патогенные микроорганизмы. Среди множества микроорганизмов, играющих роль в развитии НЭК, обнаруживаются не только патогенные (болезнетворные) штаммы микробов, но и нормальная флора кишечника ребёнка, которая может становиться патогенной. Чаще всего выявляются кишечную и синегнойную палочку, золотистый и эпидермальный стафилококк, клебсиеллу пневмонии, Clostridium perfringens, Proteus mirabilis и грибы рода Candida. Также роль в развитии НЭК могут играть ротавирусы, вирусы Коксаки типа В2, коронавирусы и цитомегаловирусы .
- Осложнения во время родов: эклампсия, диссеминированное внутрисосудистое свёртывание крови (ДВС-синдром), гипотоническое маточное кровотечение и т. д.
- Потребление во время беременности наркотических препаратов, таких как кокаин.
К факторам риска также относят применение у детей некоторых лекарственных препаратов. Серди них:
- Индометацин, который используется для закрытия артериального протока у недоношенных детей. Этот препарат может нарушить мезентериальный (кишечный) кровоток, что повышает риск развития НЭК .
- Н-2 блокаторы (Циметидин, Ранитидин и Фамотидин) и ингибиторы протонной помпы. Эти препараты подавляют кислотность желудочного сока. У новорождённых высококислотная среда регулирует количество патогенных микробов в кишечнике, тем самым предотвращает инфекционные и воспалительные реакции, ведущие к НЭК .
- Антибиотики широкого спектра действия, если их применять в течение 5 и более дней (не по поводу НЭК) .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы некротического энтероколита новорождённых
Большинство недоношенных детей до развития НЭК в целом здоровы, хорошо развиваются и растут. Самое частое проявление болезни — внезапное изменение толерантности к кормлению, т. е. непереносимость пищи. При этом желудок ребёнка медленнее опорожняется и в нём увеличивается количество остатков пищи. Из-за этого перед кормлением по зонду поступает смесь или молоко от прошлого кормления. Также часто возникает вздутие и боль в животе, иногда с рвотой.
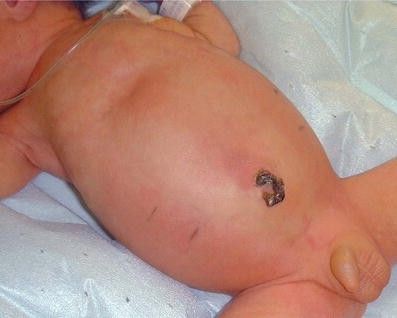
Вздутие живота при НЭК [7]
Признаки НЭК могут включать диарею, ректальное кровотечение, желчное отделяемое по зонду, покраснение и уплотнение брюшной стенки, а также крепитацию (потрескивающие, хлопающие звуки).
Иногда возникает апноэ, дыхательная недостаточность, вялость и нестабильность температуры. В тяжёлых случаях, например на фоне септического шока, может развиваться гипотензия (снижение артериального давления).
Патогенез некротического энтероколита новорождённых
Основным компонентом развития НЭК является ишемия (дефицит кровоснабжения) кишечной стенки. У недоношенных детей ишемия обычно развивается на фоне других состояний: гипоксемии (дефицита кислорода), гиповолемии (снижения объёма циркулирующей крови) или кардиогенных нарушений. Эти состояния могут быть опасны для жизни, и, чтобы поддержать жизнедеятельность организма, возникает централизация кровообращения — перенаправление кровотока в жизненно важные органы, а именно в мозг и сердце. При этом в другие органы и ткани крови поступает меньше — возникает ишемия. Т. е. централизация кровообращения и вызванная этим ишемия является защитной реакцией организма, направленной на то, чтобы выжить.
Немаловажной причиной развития НЭК у недоношенного ребёнка является инфекция. НЭК, как правило, развивается на 7–10-й день жизни, когда кишечник новорождённого уже колонизирован микробами. В норме барьерная функция слизистой кишки предотвращает проникновение микробов из просвета кишки в кровоток. Однако у недоношенных младенцев барьерная функция кишечника несовершенна из-за сниженного неспецифического иммунитета, низкого pH желудочного и кишечного сока, недоразвитой системы ферментов, сниженной кишечной перистальтики (сокращений) и недоразвития ворсинок слизистой. Всё это позволяет инфекционному агенту нарушать целостность кишечной стенки .
Классификация и стадии развития некротического энтероколита новорождённых
В большинстве отделений интенсивной терапии используются критерии стадирования по M. Bell . Классификация основана на тяжести системных, кишечных, рентгенологических и лабораторных признаков. Каждая последующая стадия включает в себя характеристики предыдущей, а также дополнительные данные, связанные с возрастающей тяжестью заболевания.
Классификация по M. Bell (1979) в модификации М. С. Walsh и R. M. Kliegman (1987)
| Стадия | Классификация НЭК | Системные проявления | Абдоминальные проявления (связанные с животом) | Радиологические проявления |
|---|---|---|---|---|
| 1А | Подозреваемый НЭК | Повышение температуры, апноэ, брадикардия (замедленный пульс), выраженная вялость | Застой в желудке, вздутие живота, рвота, скрытая кровь в стуле | Нормальные или незначительно расширенные петли кишечника |
| 1В | Подозреваемый НЭК | Те же | + Видимая примесь крови в стуле | Те же |
| 2А | Лёгкая форма НЭК | Те же | + Отсутствие кишечных шумов с болью или без неё при пальпации (прощупывании) | + Расширение кишечника, непроходимость, пневматоз кишечной стенки (полости с воздухом в стенке кишки) |
| 2В | Среднетяжёлая форма НЭК | + Умеренный метаболический ацидоз (повышение кислотности крови из-за нарушения обмена веществ) и тромбоцитопения (снижение количества тромбоцитов) | + Явная боль при пальпации с отёком и воспалением передней брюшной стенки (или без них), в правом нижнем квадранте живота может прощупываться образование | + Асцит (скопление жидкости в брюшной полости) |
| 3А | Прогрессирующий НЭК, тяжёлое течение (без повреждения кишки) | + Гипотензия, тяжёлое апноэ, сочетание метаболического и респираторного ацидоза (т. е. повышение кислотности крови как из-за нарушения обмена веществ, так и из-за дыхательной недостаточности), ДВС-синдром, нейтропения (низкий уровень нейтрофилов в крови) | + Признаки перитонита (боли в животе, слабость, тошнота, рвота, повышение температуры тела), выраженная болезненность, вздутие живота | Те же |
| 3В | Прогрессирующий НЭК, тяжёлое течение (перфорация кишечника) | Те же | Те же | + Пневмоперитонеум (воздух в брюшной полости) |
Осложнения некротического энтероколита новорождённых
При НЭК могут возникнуть серьёзные осложнения:
- Инфекционные: сепсис, менингит, перитонит, абсцессы.
- ДВС-синдром, который может привести к кишечному и внекишечному кровотечению.
- Респираторные и сердечно-сосудистые нарушения: гипотензия, шок, дыхательная недостаточность.
- Метаболические осложнения: гипогликемия и метаболический ацидоз.
- Некроз кишечника без перфорации.
- Перфорация кишечника .
Диагностика некротического энтероколита новорождённых
Чаще всего диагноз ставится на основании клинической картины (симптомов и результатов осмотра), а также данных рентгенографии или ультразвукового исследования (УЗИ). Такой диагноз называют клиническим.
Точный диагноз можно установить только при операции или по результатам гистологического исследования, которое показывает признаки воспаления, инфаркта и некроза кишечной стенки. Такой диагноз называют гистологическим. Однако большинство пациентов хорошо реагируют на медикаментозную терапию и операция им не требуется.
Инструментальная диагностика
Решающее значение в постановке диагноза имеет визуализация брюшной полости.
Рентгенография
Предпочтительным методом считается рентгенография . Характерные рентгенологические признаки:
- Аномальное газовое наполнение с расширенными петлями кишечника, характерное для кишечной непроходимости. Может наблюдаться на ранних стадиях НЭК, но это неспецифический признак: он может быть не только при НЭК .
- Пневматоз кишечника в виде пузырьков газа в стенке кишки. Это отличительный (специфичный) признак НЭК, он наблюдается у большинства пациентов на 2–3 стадии. Нужно учитывать, что есть и другие состояния, при которых может наблюдаться пневматоз кишечной стенки (тифлит, ишемия кишечника, аллергия на белок коровьего молока, энтероколит с непереносимостью пищевого белка). Но если пневматоз кишечника выявлен у недоношенного новорождённого, это указывает на НЭК, пока не доказано обратное.
- Пневмоперитонеум (свободный воздух в брюшной полости). Обычно возникает при перфорации кишечника у детей с НЭК на стадии 3В. Это неспецифический признак, он может наблюдаться и при других состояниях, например при спонтанной перфорации кишечника.
- «Сигнальная» петля кишки. Это петля, которая остаётся фиксированной на снимках в разных проекциях и сделанных в разное время. Она указывает на некротизированную кишку или перфорацию.
- Газ в системе воротной вены.
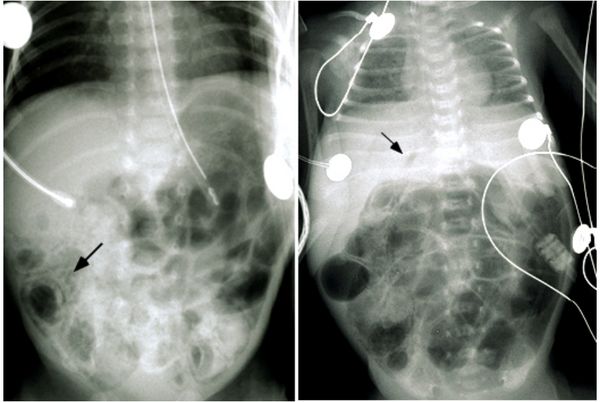
Обширный пневматоз кишечника (слева) и подозрение на газ в системе воротной вены или пневмоперитонеум (справа) [43]
Рентгенограммы выполняют в положении лёжа на спине. Если есть подозрение на пневмоперитонеум, делают боковую проекцию или кладут ребёнка на левый бок.
Контрастная рентгенография толстой кишки обычно не проводится при подозрении на НЭК, так как это может привести к перфорации. Её могут выполнить только в той ситуации, когда нужно исключить другие патологии кишечника, например мекониальный илеус или мальротацию .
Ультразвуковое исследование
В диагностике НЭК всё чаще используется УЗИ с цветным допплеровским картированием (ЦДК), особенно если по данным рентгена остались сомнения . Преимущества метода: на УЗИ лучше видно жидкость в брюшной полости, есть возможность оценить толщину стенки кишки, её перистальтику (сокращения) и перфузию (кровоснабжение). Но исследование не всегда доступно круглосуточно и для его качественного проведения необходим опытный специалист.
На УЗИ можно выявить:
- Изменение толщины стенки кишечника. Утолщение кишечной стенки до 2–3 мм и усиление кровотока в ней — начальный признак воспаления. Истончение с симптомом псевдопочки может указывать на некроз кишки и надвигающуюся перфорацию. При симптоме псевдопочки изображение поражённого участка кишки напоминает почку: есть центральный эхогенный очаг (он светлый, яркий) и гипоэхогенный ободок (тёмный).
- Повышенная эхогенность стенки кишки. Это говорит о воспалении, отёке и повышенной перфузии.
- Пневматоз кишечника, т. е. скопление пузырьков газа в стенке кишки. Пузырьки газа также могут появляться в печени и системе воротной вены.
- Отсутствие кровотока в кишечной стенке может указывать на её некроз.
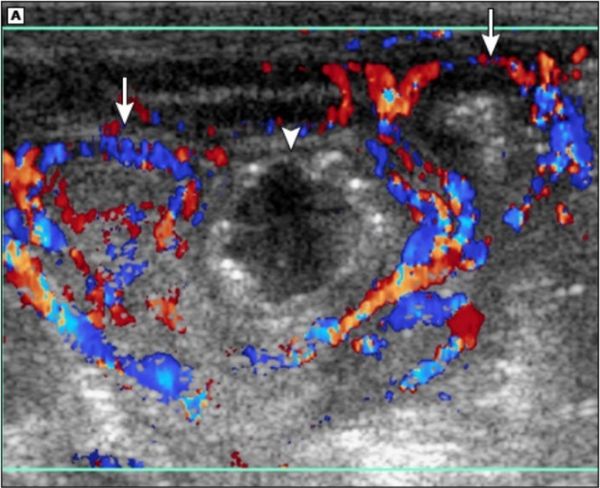
УЗИ с ЦДК: три петли кишечника, в наружных петлях усиленный кровоток, в центральной кровотока нет, что указывает на её некроз [39]
- Свободный воздух и жидкость в брюшной полости. Указывают на перфорацию кишки.
- Отсутствие или снижение перистальтики.
- Вздутие петель кишечника, заполненных жидкостным содержимым.
На 2–3-й стадии НЭК обычно имеется сразу несколько ультразвуковых находок: газ в воротной вене, свободная жидкость в брюшной полости, снижение или отсутствие перистальтики кишечника, утолщение его стенки .
При 3-й стадии на УЗИ отмечаются структурные изменения в стенки кишки: не видно разделения на слои, в стенке определяются пузырьки газа, кровоток снижен или отсутствует. Также выявляется газ в воротной вене, свободная жидкость или эхогенный выпот в брюшной полости, перистальтика кишок отсутствует.
Лабораторная диагностика
Лабораторные тесты не используют, чтобы поставить диагноз «НЭК», так как нет таких анализов, которые бы точно указывали на болезнь. Но такие исследования могут быть полезны, чтобы определить тяжесть и стадию заболевания .
Могут выполняться:
- Общий анализ крови. У пациентов с НЭК часто наблюдается нейтропения (сниженное количество нейтрофилов). Уровень нейтрофилов менее 1500/мклитр, как правило, связан с плохим прогнозом. Часто отмечается тромбоцитопения, которая может привести к значительному кровотечению. На ранних стадиях НЭК снижение тромбоцитов указывает на некроз кишки и ухудшение, а последующее повышение тромбоцитов свидетельствует об улучшении состояния .
- Коагулограмма. Не назначается рутинно, но её следует проводить при низком уровне тромбоцитов или кровотечении, потому что у младенцев с тяжёлым НЭК часто обнаруживается ДВС-синдром. При этом отмечается снижение уровня тромбоцитов, концентрации фактора V и фибриногена, увеличение уровня продуктов расщепления фибрина (Д-димера).
- Биохимический анализ крови. Обычно измеряют уровень электролитов, мочевину, креатинин и pH. Электролитные нарушения неспецифичны. Однако стойкое снижение уровня натрия (< 130 ммоль/л), повышение уровня глюкозы и метаболический ацидоз указывают на некроз кишечника или сепсис.
- Анализ крови на кислотно-щелочное состояние.
- Определение уровня лактата в крови. Может использоваться, чтобы отслеживать метаболический ацидоз, который выступает в качестве индикатора прогрессирования заболевания.
- Бактериологический посев (культуральный метод). Этот анализ позволяет определить, какие именно патогенные микроорганизмы участвуют в развитии НЭК. Выделение бактериальной флоры при НЭК возможно из крови, кала, желудочного содержимого и из брюшной полости во время операции. Чаще всего обнаруживаются кишечная палочка, золотистый стафилококк, клебсиелла пневмонии и другие микроорганизмы.
Особенности диагностики
НЭК сложно диагностировать у детей с врождёнными пороками развития, а также у глубоко недоношенных младенцев, которые находятся в крайне тяжёлом состоянии. Это связано с тем, что признаки НЭК у таких детей обычно замаскированы другими более выраженными симптомами фоновой патологии.
В таких случаях, чтобы подтвердить или исключить НЭК, выполняется диагностический лапароцентез — прокол передней брюшной стенки. Если при этом из брюшной полости получают более 1 мл жёлто-коричневой, мутной или зелёной жидкости, это указывает на некроз кишки.
Примерно в трети случаев подозреваемый НЭК не подтверждается, и симптомы постепенно исчезают. В 25–40 % случаев НЭК протекает молниеносно: от начала симптомов до перфорации могут пройти всего сутки. При этом болезнь протекает с признаками перитонита и сепсиса, быстрым развитием ДВС-синдрома и шока .
Дифференциальная диагностика
В ходе диагностики врачи исключают состояния, которые похожи на НЭК, среди них:
- Инфекционный энтерит. Возбудителями могут быть кампилобактерии, сальмонеллы, шигеллы и Clostridioides difficile. Их обнаруживают при посеве стула. Однако пока неясно, играют ли они первичную роль. Рота- и энтеровирусы также могут выступать возбудителями энтерита. Вирусный энтерит характеризуется частым стулом, иногда с примесью крови, вздутием живота и вторичным сепсисом.
- Спонтанная перфорация кишечника. Представляет собой единичную перфорацию кишки в конечном отделе подвздошной или толстой кишки. Встречается в основном у детей с очень низкой массой тела при рождении (менее 1500 г). В отличие от НЭК, при спонтанной перфорации не определяется пневматоз кишечной стенки. Кроме этого, она возникает в более ранние сроки (в первую неделю жизни) и не зависит от кормления. НЭК же возникает в более позднем возрасте и после начала энтерального питания.
- Болезнь Гиршпрунга, заворот кишок, атрезия подвздошной кишки, мекониальный илеус и кишечная инвагинация. Они могут вызвать кишечную непроходимость и энтероколит. Отличить эти состояния можно с помощью рентгенографии.
- Аппендицит. Редкое заболевание среди новорождённых, клиническая картина может быть такой же, как при НЭК, диагноз можно установить по УЗИ, но обычно его ставят во время операции.
- Кишечная непроходимость с сепсисом. Её сложно отличить от ранних проявлений НЭК.
- Непереносимость коровьего молока. Это состояние редко встречается у недоношенных детей и редко возникает в возрасте до 6 недель, но может быть ошибочно диагностировано как НЭК. Может отмечаться вздутие живота с частым стулом, стул может быть с примесью крови, а в тяжёлых случаях будет отмечаться пневматоз кишечной стенки. Симптомы исчезают после назначения белкового гидролизата или аминокислотной смеси.
- Синдром индуцированного пищевыми белками энтероколита (FPIES). Может имитировать НЭК у недоношенных детей, поскольку в обоих случаях будет отмечаться пневматоз, снижение альбумина, анемия и повышение воспалительных маркеров. Но у пациентов с НЭК обычно (но не всегда) наблюдается лейкопения и тромбоцитопения, а у пациентов с FPIES отмечает лейкоцитоз, тромбоцитоз и эозинофилия (повышенный уровень лейкоцитов, тромбоцитов и эозинофилов). Симптомы исчезают после назначения гидролизата или аминокислотной смеси.
- Тромбоз мезентериальных сосудов.
- Врождённые нарушения метаболизма.
- Перфорация любого другого происхождения, а также некоторые другие состояния, при которых может возникнуть пневмоперитонеум. Например, описаны случаи его развития на фоне ИВЛ при синдроме дыхательных расстройств .
Лечение некротического энтероколита новорождённых
При подозрении на НЭК лечение начинается незамедлительно. Большинство детей с НЭК в стадии 1 и 2 получают консервативное лечение и выздоравливают без операции. Такое лечение включает: поддерживающую терапию, эмпирическую антибактериальную терапию (т. е. до получения результатов посева), лабораторный и радиологический мониторинг.
Поддерживающая терапия
- Энтеральная пауза. У детей с НЭК кишечник плохо или совсем не сокращается из-за воспаления и растяжения стенки. Чтобы уменьшить нагрузку на кишку, энтеральное питание полностью отменяют. Обычно пауза длится 10–14 дней, в этот период ребёнок получает все питательные вещества внутривенно (парентерально). Питание возобновляют постепенно, когда состояние ребёнка улучшается.
- Снижение давления в желудке с помощью назогастрального зонда. Такой зонд представляет собой трубку, которая вводится через нос или рот в желудок. Он нужен, чтобы удалить воздух и жидкость из желудка и кишечника и тем самым снизить давление на них.
- Инфузионная терапия и парентеральное питание. Проводятся внутривенно, поэтому требуют установки центрального венозного катетера.
- Сердечно-сосудистая и респираторная поддержка. Включает введение инотропных препаратов, кислородотерапию и ИВЛ.
- Коррекция метаболизма и свёртывания крови. Требуется при ДВС-синдроме и ацидозе.
Антибиотикотерапия
Не дожидаясь результата посева, где будут указаны конкретные патогенные микроорганизмы, всем младенцам с подозреваемым или подтверждённым НЭК назначаются антибиотики широкого спектра действия (Ампициллин, Гентамицин, Амикацин, Метронидазол, Клиндамицин и др.).Препараты и схему приёма врач подбирает индивидуально. Стандартная длительность антибиотикотерапии не установлена, но обычно она составляет от 7 до 14 дней .
Когда приходят результаты посева, схема и длительность антибиотикотерапии корректируется. При НЭК 1-й стадии решение об отмене антибиотиков и начале кормления может быть принято раньше, в зависимости от течения заболевания. При 2-й стадии и выше, даже при отрицательных результатах посева, антибиотикотерапия продолжается и в целом длится в течение 10–14 дней. Этого курса достаточно, если нет осложнений.
При подозрении на грибковую инфекцию назначаются противогрибковые препараты, например Флуконазол или Амфотерицин.
Лабораторный и радиологический мониторинг
Необходимой частью лечения детей с НЭК является непрерывный контроль клинических изменений: медицинские сотрудники оценивают основные показатели жизнедеятельности ребёнка (пульс, частоту дыхания, артериальное давление) и осматривают живот. Если появились изменения, указывающие на возможную перфорацию (покраснение брюшной стенки, вздутие, повышенная болезненность), срочно повторно оценивают состояние и при необходимости меняют тактику лечения. Частота обследования определяется состоянием ребёнка и скоростью прогрессирования НЭК. Живот обычно осматривают каждые 2 часа.
Лабораторный мониторинг зависит от первоначального состояния ребёнка. Анализы повторяются каждые 12–24 часа в зависимости от тяжести состояния. Проводится общий анализ крови, измерение электролитов, креатинина и мочевины, кислотно-основное состояние и уровень лактата .
Также проводится рентгенографический и/или УЗИ мониторинг: каждые 8–12 часов в течение первых дней или пока состояние младенца не улучшится.
Хирургическое лечение
Основным показанием к оперативному вмешательству при НЭК является перфорация или некроз кишечника. На некроз и перфорацию кишки указывает выявленный на рентгенограммах пневмоперитонеум. Это абсолютное показание для хирургического вмешательства.
Однако не всегда на рентгенограмме есть изменения . Если пневмоперитонеум не обнаружен, поводом для выполнения операции может стать неконтролируемое течение заболевания с развитием сепсиса.
Также абсолютным показанием к хирургическому лечению является:
- появление в брюшной полости пальпируемого (прощупываемого) опухолевидного образования, которое может говорить о наличии внутрибрюшного абсцесса (полости с гноем) или конгломерата спаянных между собой некротизированных кишечных петель;
- воспалительные изменения брюшной стенки, которые обычно появляются при наличии перитонита;
- данные лапароцентеза, когда получена мутная, зеленоватая или коричневая жидкость .
Целью операции является удаление некротизированной части кишечника и сохранение максимальной длины жизнеспособной кишки .
Хирургическое лечение при НЭК бывает двух видов: лапаротомия (реже лапароскопия) и первичный перитонеальный дренаж.
Лапаротомия проводится, если состояние ребёнка стабильное. Это открытая, или полостная, операция, которая выполняется через разрез брюшной стенки. В зависимости от конкретного случая врач выбирает один из видов лапаротомии: срединную, поперечную или трансректальную.
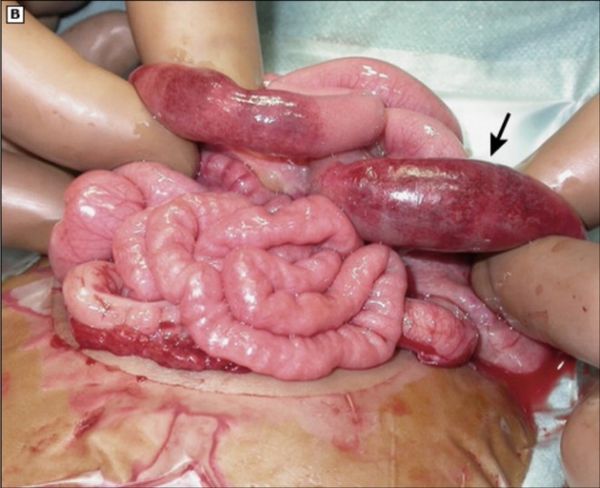
Некротизированная петля кишки [45]
В ходе операции удаляются нежизнеспособные участки кишечника и накладывается кишечная стома, т. е. отверстие кишки, сформированное после удаления части кишечника, хирургическим путём выводится на переднюю брюшную стенку. Через эту стому стул выходит из организма.
Иногда вместо лапаротомии выполняют лапароскопию. Это менее травматичная операция, она проводится через небольшие проколы в брюшной стенке. Но её используют значительно реже.
Первичный перитонеальный дренаж проводится младенцам в тяжёлом состоянии или с экстремально низким весом при рождении (менее 1000 г), так как они могут не перенести лапаротомию. В ходе этой процедуры в подвздошной области делают небольшой разрез и в брюшную полость устанавливают дренажную трубку. Основная цель первичного перитонеального дренажа — снизить давление в брюшной полости путём удаления воздуха и кишечного содержимого. Преимущество операции в том, что она может выполняться без общего наркоза в палате интенсивной терапии.
В ряде клиник дренирование является единственным методом лечения при перфорации, но большинство центров придерживается подхода, что это лишь подготовительный этап перед лапаротомией . Поэтому после стабилизации состояния обычно выполняется лапаротомия и накладывается кишечная стома.
Через 4–6 недель, в зависимости от состояния ребёнка, стомы закрывают и накладывают анастомоз, т. е. две части здорового кишечника сшивают.
При коротких зонах некроза некоторые хирурги предпочитают сразу накладывать анастомоз. Если протяжённость некротизированных петель кишечника очень большая, то удаляются явно нежизнеспособные петли кишки; если состояние кишки сомнительное, то устанавливаются дренажи и через 2–3 дня проводится повторная операция для оценки жизнеспособности. Такой подход позволяет сохранить большую длину кишечника и избежать синдрома короткой кишки.
Традиционно хирургическое лечение по поводу НЭК проводилось в операционных. Новорождённого перемещали туда из отделения реанимации или интенсивной терапии, а после операции возвращали назад. Но перемещение младенца, особенно в критическом состоянии, бывает опасно, например может сместиться жизненно важный катетер. Поэтому сейчас операции могут выполняться непосредственно в палате интенсивной терапии.
Отдалённые последствия НЭК
Желудочно-кишечные осложнения. К ним относят стриктуры (сужения) кишечника, кишечную недостаточность, рецидив НЭК, спаечную непроходимость и синдром короткой кишки . Такие осложнения могут возникать у детей, которые перенесли операцию по поводу НЭК.
Чаще всего встречаются стриктуры (сужения) кишечника. Согласно обзору литературы, они возникли у 24 % выживших детей . Большинство стриктур образуется в толстой кишке, хотя могут появиться в подвздошной и тощей кишке, а иногда встречаются в нескольких местах . У младенцев с этим осложнением возможен избыточный бактериальный рост в тонкой кишке. Из-за этого могут возникать повторные инфекции.
Если стриктуры сопровождаются симптомами, например примесью крови в стуле, вздутием живота, рвотой и другими, то обычно требуется операция. При этом удаляется стенозированный (суженный) участок кишки и затем накладывается анастомоз. Традиционно такие операции проводятся с помощью лапаротомии, но в некоторых центрах используют лапароскопию.
Примерно у 9 % младенцев, перенёсших операцию по поводу НЭК, встречается неонатальный синдром короткой кишки. Он развивается, если после операции от кишечника остаётся менее 25 % его длины. Из-за этого осложнения возникает значительная мальабсорбция, т. е. нарушается всасывание пищевых питательных веществ через желудочно-кишечный тракт . Дети с синдромом короткой кишки подвержены риску сепсиса и печёночной недостаточности .
Нарушения развития нервной системы. У детей, перенёсших НЭК, в дальнейшем чаще нарушается развитие нервной системы по сравнению с теми, у кого не было НЭК. После этой болезни повышается риск развития церебрального паралича, когнитивных и зрительных нарушений .
После хирургического лечения неврологические проблемы обычно более выражены. Но это связано не с операцией, а с более тяжёлым течением НЭК . Нужно понимать, что при наличии перфорации или некроза кишки операция — единственный способ спасти ребёнка.
Прогноз. Профилактика
НЭК по-прежнему связан с высокой смертностью: по разным данным, этот показатель колеблется от 11 до 50 %. Чем меньше вес при рождении и гестационный возраст, тем выше смертность . Однако благодаря активному развитию неонатологии и реаниматологии рождаются и выживают даже глубоко недоношенные дети с тяжёлыми пороками развития ЖКТ и сердечно-сосудистой системы, а также те, кто перенёс гипоксию и инфицирование.
Примерно у половины детей после НЭК нет никаких отдалённых последствий. У остальных встречаются желудочно-кишечные осложнения, нарушение роста и развития нервной системы .
Профилактика НЭК
Профилактика НЭК направлена на снижение факторов риска и поиск мер, которые предотвратят развитие заболевания. Поскольку НЭК практически всегда встречается у недоношенных детей, профилактика преждевременных родов может повлиять на частоту развития болезни. Но эту цель не всегда можно достичь. Поэтому чаще всего профилактика проводится уже после рождения ребёнка, осуществляют её в основном медицинские сотрудники. К мерам профилактики относят:
- Кормление недоношенных новорождённых грудным молоком, лучше всего материнским. Если у матери нет молока, рекомендуется использовать пастеризованное донорское молоко. Кормление грудным молоком (в том числе донорским) снижает риск НЭК по сравнению со смесью на основе коровьего белка . Защитный эффект грудного молока, вероятно, зависит от дозы, так как более высокое потребление грудного молока приводит к пропорционально более высокой защите от развития НЭК.
- Применение антенатальных кортикостероидов. Их назначают женщинам с риском преждевременных родов. Это противовоспалительные средства, которые способствуют созреванию лёгких младенца до рождения и тем самым снижают риск респираторного дистресс-синдрома и смертности у недоношенных детей. Также использование кортикостероидов снижает риск НЭК, внутрижелудочкового кровоизлияния и ретинопатии недоношенных .
- Использование единого протокола вскармливания недоношенных детей, который должен быть разработан в медицинских центрах и больницах. В нём содержится информация, как начинать и продолжать питание недоношенных детей. Какого-то единого и общепринятого протокола пока нет.
- Отказ от длительного применения антибиотиков широкого спектра действия. Если ребёнку нужна антибиотикотерапия (не по поводу НЭК), то предпочтительно использовать антибиотики узкого спектра по результатам посевов .
- Отказ от применения у новорождённых с очень низким весом препаратов, которые снижают кислотность желудочного сока (Н-2 блокаторов и ингибиторов протонной помпы).
- Профилактику и лечение анемии, у новорождённых для этого чаще всего проводится переливание компонентов крови.
Также к мерам профилактики можно отнести:
- Использование пробиотиков. В ряде исследований было показано, что использование пробиотиков эффективно в профилактике НЭК. Но единого мнения по поводу оптимального режима дозирования и штаммов пока нет. Также пока недостаточно данных, чтобы оценить их эффективность у крайне недоношенных детей (менее 28 недель гестации) .
- Терапию пероральными иммуноглобулинами. Предполагается, что терапия иммуноглобулинами может уменьшить риск НЭК, так как они подавляют высвобождение провоспалительных цитокинов, которые запускают процесс воспаления . Однако испытания не доказывают пользу такой терапии .
- Пищевые добавки, полученные из человеческого молока (например, лактофферин и олигосахариды). Их исследовали в качестве возможных стратегий предотвращения НЭК. Данных пока мало, и они не подтверждают, что такие добавки снижают частоту НЭК .
Список литературы
- Stoll B. J., Hansen N. I., Bell E. F. et al. Trends in Care Practices, Morbidity, and Mortality ofExtremely Preterm Neonates, 1993-2012 // JAMA. — 2015. — № 10. — Р. 1039–1051.ссылка
- Holman R. C., Stoll B. J., Curns A. T. et al. Necrotising enterocolitis hospitalisationsamongneonates in the United States // Paediatr Perinat Epidemiol. — 2006. — № 6. — Р. 498–506.ссылка
- Rees C. M., Eaton S., Pierro A. National prospective surveillance study of necrotizingenterocolitis in neonatal intensive care units // J Pediatr Surg. — 2010. — № 7. — Р. 1391–1397.ссылка
- Battersby C., Santhalingam T., Costeloe K., Modi N. Incidence of neonatal necrotisingenterocolitis in high-income countries: a systematic review // Arch Dis Child Fetal Neonatal Ed. — 2018. — № 2. — Р. F182–F189.ссылка
- Han S. M., Hong C. R., Knell J. et al. Trends in incidence and outcomes of necrotizingenterocolitis over the last 12 years: A multicenter cohort analysis // J Pediatr Surg. — 2020. — № 6. — Р. 998–1001.ссылка
- Fitzgibbons S. C., Ching Y., Yu D. et al. Mortality of necrotizing enterocolitis expressed by birthweight categories // J Pediatr Surg. — 2009. — № 6. — Р. 1072–1076.ссылка
- Boston V. E. Necrotising enterocolitis and localised intestinal perforation: different diseases or ends of a spectrum of pathology // Pediatr Surg Int. — 2006. — № 6. — Р. 477–484.ссылка
- Kenton A. B., O’Donovan D., Cass D. L. et al. Severe thrombocytopenia predicts outcome inneonates with necrotizing enterocolitis // J Perinatol. — 2005. — № 1. — Р. 14–20.ссылка
- Hällström M., Koivisto A. M., Janas M., Tammela O. Laboratory parameters predictive ofdeveloping necrotizing enterocolitis in infants born before 33 weeks of gestation // J Pediatr Surg. — 2006. — № 4. — Р. 792–798. ссылка
- Kliegman R. M., Hack M., Jones P., Fanaroff A. A. Epidemiologic study of necrotizing enterocolitisamong low-birth-weight infants. Absenceofidentifiableriskfactors // J Pediatr. — 1982. — № 3. — Р. 440–444.ссылка
- More K., Athalye-Jape G., Rao S., Patole S. Association of inhibitors of gastric acid secretion and higher incidence of necrotizing enterocolitis in preterm very low-birth-weight infants // Am J Perinatol. — 2013. — № 10. — Р. 849–856.ссылка
- Neu J. Necrotizing enterocolitis: the search for a unifying pathogenic theory leading toprevention // Pediatr Clin North Am. — 1996. — № 2. — Р. 409–432.ссылка
- Bell M. J., Ternberg J. L., Feigin R. D. et al. Neonatal necrotizing enterocolitis. Therapeuticdecisions based upon clinical staging // AnnSurg. — 1978. — № 1. — Р. 1–7.ссылка
- Solomkin J. S., Mazuski J. E., Bradley J. S. et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society andthe Infectious Diseases Society of America // ClinInfect Dis. — 2010. — № 2. — Р. 133–164. ссылка
- Smith M. J., Boutzoukas A., Autmizguine J. et al. Antibiotic Safety and Effectiveness inPremature Infants With Complicated Intraabdominal Infections // Pediatr Infect Dis J. — 2021. — № 6. — Р. 550–555. ссылка
- Shah D., Sinn J. K. Antibiotic regimens for the empirical treatment of newborn infants withnecrotising enterocolitis // Cochrane Database Syst Rev. — 2012. — № 8.ссылка
- Robinson J. R., Rellinger E. J., Hatch L. D. et al. Surgical necrotizing enterocolitis // Semin Perinatol. — 2017. — № 1. — Р. 70–79. ссылка
- Kosloske A. M. Indications for operation in necrotizing enterocolitis revisited // J Pediatr Surg. — 1994. — № 5. — Р. 663–666. ссылка
- Munaco A. J., Veenstra M. A., Brownie E. et al. Timing of optimal surgical intervention forneonates with necrotizing enterocolitis // Am Surg. — 2015. — № 5. — Р. 438–443.ссылка
- Hau E. M., Meyer S. C., Berger S. et al. Gastrointestinal sequelae after surgery for necrotisingenterocolitis: a systematic review and meta-analysis // Arch Dis Child Fetal Neonatal Ed. — 2019. — № 3. — Р. F265–F273. ссылка
- Schimpl G., Höllwarth M. E., Fotter R., Becker H. Late intestinal strictures following successfultreatment of necrotizing enterocolitis // Acta Paediatr Suppl. — 1994. — Vol. 396. — Р. 80–83. ссылка
- Horwitz J. R., Lally K. P., Cheu H. W. et al. Complications after surgical intervention fornecrotizing enterocolitis: a multicenter review // J Pediatr Surg. — 1995. — № 7. — Р. 994–999. ссылка
- Duro D., Kalish L. A., Johnston P. et al. Risk factors for intestinal failure in infants withnecrotizing enterocolitis: a Glaser Pediatric Research Network study // J Pediatr. — 2010. — № 2. — Р. 203–208.ссылка
- Autmizguine J., Hornik C. P., Benjamin D. K. Jr. et al. Anaerobic antimicrobial therapy afternecrotizing enterocolitis in VLBW infants // Pediatrics. — 2015. — № 1. — Р. e117–e125.ссылка
- Jones I. H., Hall N. J. Contemporary Outcomes for Infants with Necrotizing Enterocolitis — A Systematic Review // J Pediatr. — 2020. — Vol. 220. — Р. 86–92.ссылка
- Velazco C. S., Fullerton B. S., Hong C. R. et al. Morbidity and mortality among «big» babies whodevelop necrotizing enterocolitis: A prospective multicenter cohort analysis // J Pediatr Surg. —2017. — Vol. 53, № 1. — P. 108–112.ссылка
- Travers C. P., Clark R. H., Spitzer A. R. et al. Exposure to any antenatal corticosteroids andoutcomes in preterm infants by gestational age: prospective cohort study // BMJ. — 2017. — Vol. 356.ссылка
- Quigley M., Embleton N. D., McGuire W. Formula versus donor breast milk for feedingpreterm or low birth weight infants // Cochrane Database Syst Rev. — 2007. — № 4.ссылка
- Rina P., Zeng Y., Ying J. et al. Association of initial empirical antibiotic therapy with increasedrisk of necrotizing enterocolitis // Eur J Pediatr. — 2020. — № 7. — Р. 1047–1056.ссылка
- Wolf H. M., Eibl M. M. The anti-inflammatory effect of an oral immunoglobulin (IgA-IgG) preparation and its possible relevance for the prevention of necrotizing enterocolitis // Acta Paediatr Suppl. — 1994. — Vol. 396. — Р. 37–40.ссылка
- Foster J. P., Seth R., Cole M. J. Oral immunoglobulin for preventing necrotizing enterocolitis inpreterm and low birth weight neonates // Cochrane Database Syst Rev. — 2016. — № 4.ссылка
- Esposito F., Mamone R., Di Serafino M. et al. Diagnostic imaging features of necrotizing enterocolitis: a narrative review // Quant Imaging Med Surg. — 2017. — № 3. — Р. 336–344.ссылка
- Barczuk-Falęcka M., Bombiński P., Majkowska Z. et al. Hepatic Portal Venous Gas in Children Younger Than 2 Years Old — Radiological and Clinical Characteristics in Diseases Other Than Necrotizing Enterocolitis // Pol J Radiol. — 2017. — Vol. 82. — Р. 275–278.ссылка
- Нассер М. М. А. М. Заболеваемость и лечебно-диагностическая тактика ведения новорождённых с язвенно-некротическим энтероколитом // Бюллетень медицинских интернет-конференций. — 2014. — № 5. — С. 719.
- Rich B. S., Dolgin S. E. Necrotizing Enterocolitis // Pediatr Rev. — 2017. — № 12. — Р. 552–559.ссылка
- Zani A., Eaton S., Puri P., Rintala R. et al. International survey on the management of necrotizing enterocolitis // Eur J Ped Surg. — 2015. — № 1. — Р. 27–33.ссылка
- Караваеа С. А., Горелик Ю. В., Попова Е. Б. и др. Некротический энтероколит и меконеальный илеус недоношенных — дифференциальный диагноз и лечение: учебное пособие. — СПб., 2017.
- Springer S. C. Necrotizing Enterocolitis // Medscape. — 2017.
- Kim J. H. Neonatal necrotizing enterocolitis: Clinical features and diagnosis // UpToDate. — 2020.
- Rees C. M., Pierro A., Eaton S. Neurodevelopmental outcomes of neonates with medically and surgically treated necrotizing enterocolitis // Arch Dis Child Fetal Neonatal Ed. — 2007. — № 3. — Р. F193–F198.ссылка
- Griffiths J., Jenkins P., Vargova M. et al. Enteral lactoferrin to prevent infection for very preterm infants: the ELFIN RCT // Health Technol Assess. — 2018. — № 74. — Р. 1–60.ссылка
- Маммадова Т. А. Факторы риска некротического энтероколита у доношенных новорождённых // Международный журнал прикладных и фундаментальных исследований. — 2020. — № 6. — С. 45–49.
- Radiograph of necrotizing enterocolitis in premature infants // UpToDate. — 2018.
- Исмаилова М. А., Сулейманова Л. И., Азимова Ш. А., Алангова М. З. Исходы некротического энтероколита у новорожденных // Материалы XIII Международной студенческой научной конференции «Студенческий научный форум». — 2021.
- Epelman M., Daneman A., Navarro O. M. et al. Necrotizing Enterocolitis: Review of State-of-the-Art Imaging Findings with Pathologic Correlation // RadioGraphics. — 2007. — Vol. 27, № 2.— Р. 285–305.ссылка