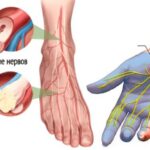
Невральная амиотрофия Шарко — Мари — Тута (Charcot-Marie-Tooth disease) — это группа наследственных периферических невропатий, при которых поражаются нервы рук и ног . Заболевание неуклонно прогрессирует: поражение нервов приводит к ухудшению, а затем и потере чувствительности, слабости мышц с последующим уменьшением их объёма (атрофии) и изменению формы стопы.
Синонимы: болезнь Шарко — Мари — Тута, мышечная атрофия Шарко — Мари, мышечная атрофия перонеального типа, наследственная невральная амиотрофия.
Невральная амиотрофия Шарко — Мари — Тута
Распространённость
В мире этим заболеванием страдает примерно 1 из 2500 человек . В восточной части округа Акерсхус, Норвегия, распространённость в два раза выше (1:1214), в то время как в Японии она ниже, чем во всём мире, и составляет 1:9200 . В США амиотрофия Шарко — Мари — Тута является наиболее распространённым наследственным неврологическим заболеванием, от которого страдают примерно 150 000 американцев (1:2500 жителей).
В нашей стране заболевание составляет около 80 % всех наследственных невропатий и обнаруживается примерно у 7–13 человек на 100 000 населения .
Причины мышечной атрофии Шарко — Мари
Известно более 90 различных генетических мутаций, связанных с невропатией Шарко — Мари — Тута . Но около 90 % генетически подтверждённых случаев вызваны изменениями в четырёх генах: PMP22, MPZ, GJB1 и MFN2 .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы невральной амиотрофии Шарко — Мари — Тута
Заболевание может проявиться в разном возрасте: у некоторых пациентов — в младенчестве, у других — в пожилом возрасте . Но, как правило, болезнь дебютирует в возрасте от 10 до 20 лет.
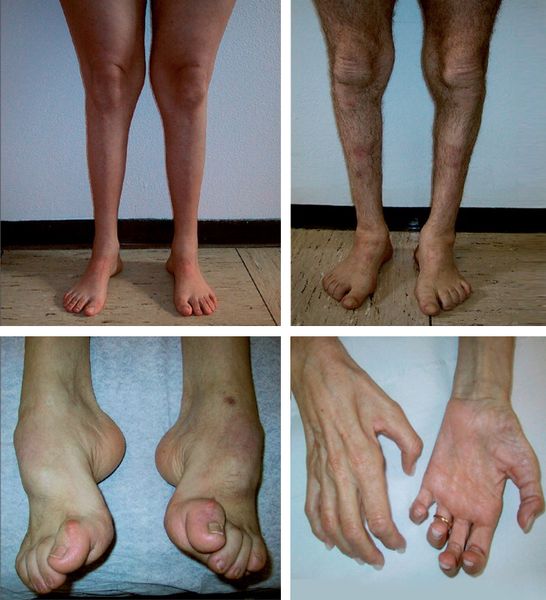
Заболевание обычно начинается со слабости в обеих ногах. Типичными являются нарушения в стопах и лодыжках — страдают мышцы-разгибатели голени, мелкие мышцы и тыльные мышцы-сгибатели стопы. Атрофия мышц стопы приводит к «когтевидной» постановке пальцев, что проявляется свисанием стопы. Слабость в ногах ведёт к изменению походки по типу «степпажа» (от фр. steppage — бег рысью): больной при ходьбе высоко поднимает ноги, выбрасывает стопы вперёд и резко опускает. По-другому такую походку называют петушиной.
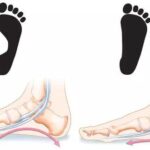
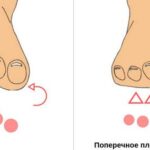
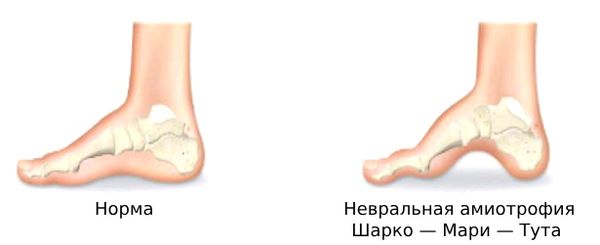
По мере прогрессирования болезни стопы начинают подворачиваться и деформироваться. Формируется вальгусная установка стопы — поворот кнаружи, увеличивается свод и образуется «полая стопа» (pescavus). С годами ноги приобретают вид «перевёрнутых бутылок» (широкое колено и худая голень со стопой), или «ног аиста» . Из-за всех этих симптомов пациенту становится тяжело бегать, он часто спотыкается и падает .
Симптомы амиотрофии Шарко — Мари — Тута [32]
Со временем поражаются и нервы рук: появляется слабость, а затем и атрофия мышц кисти. В связи с этим она становится похожей на лапу обезьяны — «когтистая лапа». Кроме того, нарушается чувствительность, в первую очередь поверхностная. Это значит, что человек хуже различает температуру и прикосновения. Эти нарушения локализуются в кистях, по типу «перчаток». Кроме того, возникают парестезии — ощущение жжения, ползания мурашек и покалывания. Иногда наблюдается цианоз (синюшность) и отёки поражённых кистей. В некоторых случаях в этих же зонах возникает боль и нарушается глубокая чувствительность (например, если пациент не смотрит на свои пальцы, то ему трудно определить, к какому пальцу прикоснулся другой человек).
Заметить симптомы амиотрофии у маленьких детей сложнее, чем у взрослых. Её можно заподозрить, если ребёнок становится неуклюжим, ходит, не отрывая ног от земли, а когда поднимает ноги, пальцы свисают вниз .
Патогенез невральной амиотрофии Шарко — Мари — Тута
Нерв покрыт оболочкой, содержащей миелин — вещество, благодаря которому проводится нервный импульс. Изнутри миелиновая оболочка граничит с поверхностной мембраной аксона — длинного отростка нервной клетки, проводящим импульс от нейрона к другим нервным клеткам и тканям. Вдоль аксональных микротрубочек перемещаются различные структуры клетки и основные элементы, включая генетический материал и питательные вещества. Такой транспорт называется аксональным, он очень энергозатратный и нуждается в питательно-энергетической поддержке .
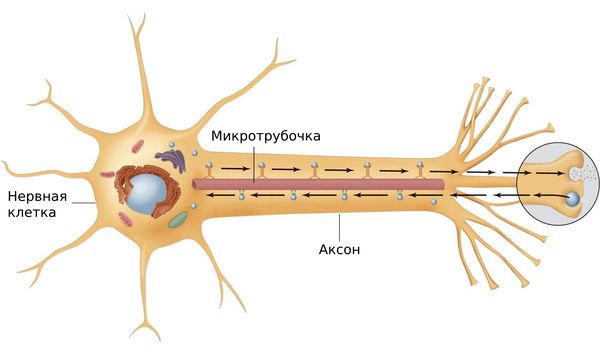
Аксональный транспорт
Многие формы наследованных невропатий вызваны мутациями в генах, которые участвуют в аксональном транспорте. В 70–80 % случаев болезнь развивается из-за нарушения в хромосоме 17р12, включающей ген РМР22, который кодирует один из миелиновых белков .
Повышенная выработка белка РМР22 приводит к нарушению миелинизации нервных волокон (покрытию нерва миелиновой оболочкой). Шванновские клетки не образуют многослойный компактный миелин, а наслаиваются друг на друга, подобно чешуйкам луковицы. Это сопровождается разрастанием эндоневральной соединительной ткани, из-за чего нерв существенно утолщается. В результате замедляется передача электрических импульсов и ухудшается питание мышц. Чаще страдают «быстрые» двигательные нервные волокна, которые иннервируют мышцы стопы и голени. Несколько меньше и позже повреждаются более короткие мышцы кистей и предплечий; также повреждаются и чувствительные нервы.
Повреждение нервов приводит к развитию вторичной мышечной атрофии. Механизм повреждения зависит от типа амиотрофии: демиелинизирующего (CMT1) и аксонального (CMT2) . При первом типе повреждается миелиновая оболочка и снижается скорость проведения нервного импульса. При аксональном типе поражается сам отросток нервной клетки, что проявляется не только нарушениями чувствительности и мышечной слабостью (это свойственно и демиелинизирующей форме), но и трофическими нарушениями — проблемам с питанием и обменом веществ в тканях.
Классификация и стадии развития невральной амиотрофии Шарко — Мари — Тута
В качестве основных критериев классификации используется характер наследования и молекулярно-генетические особенности болезни.
Выделяют четыре типа невральной амиотрафии:
- Амиотрофия 1-го типа. Встречается наиболее часто — около 50 % всех случаев. Тип наследования аутосомно-доминантный (достаточно, чтобы мутантный ген был у одного родителя). Генетический дефект может быть получен от любого родителя, как правило люди обоих полов болеют одинаково часто. При болезни 1-го типа встречаются мутации 4 генов миелиновых белков (PMP22, MPZ, LITAF, EGR2) . При таком типе амиотрофии разрушается миелиновая оболочка двигательного нерва, в результате чего снижается скорость проведения нервного импульса. В среднем, по данным электромиографии (ЭМГ), она составляет менее 38 м/с (при норме — 40–70 м/с) .
- Амиотрофия 2-го типа. По распространённости находится на втором месте: примерно 20–40 % от всех случаев. Также имеет аутосомно-доминантный тип наследования. В развитии заболевания участвуют шесть генов: MFN2, RAB7, GARS, NFL/EFL, MPZ/Po, LAMIN A/C . При заболевании в первую очередь разрушается аксон, скорость проведения нервного импульса может оставаться нормальной или слегка снижаться, но, как правило, составляет более 38 м/с . При данном типе поражаются преимущественно ноги. Симптомы, как правило, менее выражены, и течение более лёгкое, чем при болезни 1-го типа.
- Промежуточная форма. Аутосомно-доминантное наследование, сочетание миелино- и аксонопатии, встречается редко. При обследовании выявляют пограничные значения скорости проводимости — между 25 и 45 м/с .
- Амиотрофия 4-го типа. Редкая группа прогрессирующих моторных и сенсорных аксональных и демиелинизирующих невропатий — встречается в 10–20 % от всех случаев. Тип наследования аутосомно-рецессивный (мутантный ген должен быть у обоих родителей). У мужчин проявляется моторной и сенсорной невропатией от умеренной до тяжёлой степени, у женщин-носительниц, как правило, протекает легко или бессимптомно .
Осложнения невральной амиотрофии Шарко — Мари — Тута
К осложнениям заболевания можно отнести:
- деформации стоп и кистей;
- сколиоз (деформация скелета, которая проявляется боковым смещением позвоночника);
- кифосколиоз (искривление не только в боковой, но и в передне-задней плоскости с образованием выпуклости);
- нарушение ходьбы и навыков самообслуживания;
- дыхательная недостаточность из-за поражения диафрагмального нерва .
Эти осложнения могут развиться, если регулярно не заниматься физическими упражнениями, индивидуально подобранными врачом лечебной физкультуры или реабилитологом.
Диагностика невральной амиотрофии Шарко — Мари — Тута
Диагностика основана на сборе анамнеза (истории болезни), осмотре и генетическом тестировании.
Сбор анамнеза
На приёме врач выясняет семейный анамнез трёх поколений с особым вниманием к родственникам с неврологическими симптомами: слабостью в руках и ногах, нарушением чувствительности. Если это возможно, диагноз у родственников нужно подтвердить, так как это поможет правильно поставить диагноз пациенту.
Однако не у всех пациентов с невральной амиотрофией родственники тоже страдают этим заболеванием. Это может быть связано со слабым проявлением болезни у других членов семьи и аутосомно-рецессивным наследованием. Чтобы заболеть наиболее распространёнными типами невральной амиотрофии, человек должен унаследовать две изменённые копии одного и того же гена от каждого из родителей. Родители пациента с аутосомно-рецессивным диагнозом являются носителями одного патогенного варианта, поэтому не подвержены риску развития заболевания . Также болезнь может иметь Х-сцеплённое наследование, при котором только у мужчин развивается заболевание, а женщины являются носительницами дефектного гена .
Инструментальные исследования
Для подтверждения диагноза проводят электромиографию и исследование нервной проводимости.
Электромиография
Генетическое тестирование
Если доктор заподозрил невральную амиотрофию Шарко — Мари — Тута, то он направит пациента в центр нейрогенетики или к генетическому консультанту, специализирующемуся на нейрогенетике.
Генетик назначит молекулярно-генетическое тестирование. Обычно сначала исследуют дупликацию/делецию гена PMP22. Затем проводится исследование на мультигенной панели, включающей восемь наиболее часто вовлекаемых генов: GDAP1, GJB1, HINT1, MFN2, MPZ, PMP22, SH3CT2 и SORD. Заключительным этапом может следовать комплексное геномное тестирование (NGS), при котором исследуют все гены, после чего делают вывод, какой именно дефектный ген привёл к развитию болезни . Комплексное геномное тестирование может быть назначено, если генетическая причина не была идентифицирована на предыдущих двух этапах.
За последние два десятилетия секвенирование стали применять чаще, благодаря чему было выявлено более 120 генов, ответственных за развитие амиотрофии Шарко — Мари — Тута .
Дифференциальная диагностика
Невральную амиотрофию Шарко — Мари — Тута необходимо отличать от следующих заболеваний:
- Системных расстройств с невропатией. При таких патологиях может нарушаться зрение, вплоть до слепоты, могут возникать судороги, деменция (снижение умственных способностей, в том числе памяти, внимания и ухудшение речи). Для невральной амиотрофии не характерно снижение умственных способностей, при таком симптоме предполагают другой диагноз, включая расстройства детского возраста со значительным поражением ЦНС: метахроматическую лейкодистрофию, болезни Краббе и Пелицеуса — Мерцбахера, синдром Лоу .
- Других типов наследственных невропатий (например, болезни Дежерина — Сотта).
- Генетических дистальных миопатий (например, миопатий Миоши и Лейна).
- Наследственных сенсорных и вегетативных невропатий (например, синдрома Райли — Дея).
- Приобретённых невропатий: алкогольных интоксикаций, дефицита витамина B12, заболеваний щитовидной железы, сахарного диабета, ВИЧ-инфекции, васкулита, нейросифилиса, отложения амилоида, связанного с хроническим воспалением, скрытых новообразований, интоксикации тяжёлыми металлами, а также воспалительных и иммуноопосредованных невропатий, например хронической воспалительной демиелинизирующей полинейропатии.
Лечение невральной амиотрофии Шарко — Мари — Тута
Доказанных способов повлиять на механизмы развития болезни пока не существует. Но лечение позволяет улучшить питание мышц, проводимость нервных импульсов, сохранить двигательную активность, предотвратить костно-суставные деформации и появление скованности движений (контрактуры).
При грубой костной деформации, вызывающей боль или ограничивающей передвижение, может потребоваться хирургическое лечение. В зависимости от степени деформации стопы может помочь удлинение ахиллова сухожилия, трансплантация сухожилия, коррекция молоткообразного пальца и высвобождение подошвенной фасции. Однако таких операций можно избежать, если носить ортез, заниматься ЛФК и наблюдаться у физиотерапевта.
При контрактурах, умеренной деформации позвоночника и асимметричном укорочении конечностей применяют ортезы и вспомогательные средства ходьбы, например трость.
Одним из наиболее эффективных методов профилактики и лечения контрактур при болезни Шарко — Мари — Тута является стрейч-терапия — комплекс определённых упражнений, направленных на растяжение мышц, увеличение длины мышечно-связочного аппарата и диапазона движений в суставах .
Основные цели стрейч-терапии при невральной амиотрофии:
- улучшить подвижность суставов;
- предупредить и компенсировать укорочение ахилловых сухожилий и камбаловидной мышцы (части трёхглавой мышцы голени);
- повысить способность длительно находиться в статическом положении без усталости и дискомфорта ;
- улучшить равновесие и ходьбу .
Упражнения на растяжку
При возникновении хронического болевого синдрома используется симптоматическая терапия антидепрессантами или антиконвульсантами.
Пациентам также желательно удобно обустроить быт, например установить на дверные ручки специальные резиновые накладки, чтобы их проще было открывать, заменить одежду с пуговицами на одежду с кнопками, носить ортопедическую обувь с высоким голенищем, чтобы поддерживать лодыжку, использовать специальные стельки, а при необходимости — трость или ходунки . Также может пригодиться инвалидная коляска, но только для того, чтобы время от времени разгружать ноги .
Сейчас ведутся поиски методов лечения, которые позволят полностью избавиться от этой болезни. Таким методом может стать, например, генная терапия. Однако разработать такое лечение очень сложно, так как есть огромное количество генов, связанных с заболеванием, и многие из них пока даже не выявлены.
Прогноз. Профилактика
Невральная амиотрофия Шарко — Мари — Тута неизлечима, но развивается медленно и практически не влияет на продолжительность жизни . Иногда период между дебютом болезни и атрофией мышц рук длится до 10 лет. Даже несмотря на развившуюся атрофию, пациенты довольно долго сохраняют двигательную активность, могут себя обслуживать и даже работать, если занимаются лечебной физкультурой и физической терапией. Чтобы держать болезнь под контролем, нужно каждый день тренироваться и регулярно проходить все обследования, которые назначает врач.
Также рекомендуется:
- заниматься плаванием или ездить на велосипеде — при такой активности нет ударной нагрузки, поэтому она меньше нагружает мышцы, но при этом держит их в тонусе, помогает улучшить координацию и равновесие;
- регулярно стричь ногти на ногах и следить за тем, чтобы на коже не появлялись мозоли, раны и язвы, которые можно пропустить при сниженной чувствительности ног; при их появлении сразу обращаться к врачу, чтобы не допустить развития инфекции;
- поддерживать нормальный вес, чтобы не нагружать суставы;
- не курить и не употреблять напитки с кофеином, если есть тремор;
- по возможности отказаться от алкоголя — он не токсичен для нервов, т. е. не влияет на течение болезни, но может повлиять на координацию и походку, чем повышает риск получить травму или перелом;
- лечить сахарный диабет;
- избегать приёма таких химиопрепаратов, как Винкристин, Паклитаксел, Доцетаксел и Кабазитаксел, так как они могут усугубить течение болезни .
Специфических методов профилактики не существует. При выявлении болезни необходимо пройти генетическое консультирование и молекулярно-генетическое тестирование, чтобы оценить риски для будущих поколений.
Список литературы
- Buteică E., Roşulescu E., Stănoiu B. et al. Charcot-Marie-Tooth disease // Rom J Morphol Embryol. — 2008. — № 1. — Р. 115–119.ссылка
- Barreto L. C., Oliveira F. S., Nunes P. S. et al. Epidemiologic Study of Charcot-Marie-Tooth Disease: A Systematic Review // Neuroepidemiology. — 2016. — № 3. — Р. 157–165. ссылка
- Skre H. Genetic and clinical aspects of Charcot-Marie-Tooth’s disease // Clin Genet. — 1974. — № 2. — Р. 98–118. ссылка
- Глущенко Е. В. Клинико-генетическая характеристика наследственной невропатии Шарко — Мари — Тута (на примере Красноярского края): автореф. дис. … канд. мед. наук: 4.01.11. — Красноярск, 2011. — 130 с.
- Pisciotta C., Shy M. E. Neuropathy // Handb Clin Neurol. — 2018. — Vol. 148. — P. 653–665. ссылка
- Saporta A. S., Sottile S. L., Miller L. J. et al. Charcot-Marie-Tooth disease subtypes and genetic testing strategies // Ann Neurol. — 2011. — № 1. — Р. 22–33. ссылка
- Fridman V., Saporta M. A. Mechanisms and Treatments in Demyelinating CMT // Neurotherapeutics. — 2021. — № 4. — Р. 2236–2268. ссылка
- Miniou P., Fontes M. Therapeutic Development in Charcot Marie Tooth Type 1 Disease // Int J Mol Sci. — 2021. — № 13.ссылка
- Beijer D., Sisto A., Baets J. et al. Defects in Axonal Transport in Inherited Neuropathies // J Neuromuscul Dis. — 2019. — № 4. — Р. 401–419. ссылка
- Wang Y., Han J., Zhang J. et al. MORC2 p.R252W Mutant Axonal Charcot-Marie-Tooth Disease Causes Peripheral Neuropathies and Pathological Myofiber Destruction // Balkan Med J. — 2022. — № 3. — Р. 222–223. ссылка
- Stone E. J., Kolb S. J., Brown A. A review and analysis of the clinical literature on Charcot-Marie-Tooth disease caused by mutations in neurofilament protein L // Cytoskeleton (Hoboken). — 2021. — № 3. — Р. 97–110. ссылка
- Yalcouyé A., Esoh K., Guida L., Wonkam A. Current profile of Charcot-Marie-Tooth disease in Africa: A systematic review // J Peripher Nerv Syst. — 2022. — № 2. — Р. 100–112. ссылка
- Pipis M., Rossor A. M., Laura M., Reilly M. M. Next-generation sequencing in Charcot-Marie-Tooth disease: opportunities and challenges // Nat Rev Neurol. — 2019. — № 11. — Р. 644–656.ссылка
- Rudnik-Schöneborn S., Tölle D., Senderek J. et al. Diagnostic algorithms in Charcot-Marie-Tooth neuropathies: experiences from a German genetic laboratory on the basis of 1206 index patients // Clin Genet. — 2016. — № 1. — Р. 34–43. ссылка
- Bird T. D., Adam M. P., Mirzaa G. M. et al. Charcot-Marie-Tooth Hereditary Neuropathy Overview // GeneReviews. — 2003.ссылка
- Cortese A., Wilcox J. E., Polke J. M. et al. Targeted next-generation sequencing panels in the diagnosis of Charcot-Marie-Tooth disease // Neurology. — 2020. — № 1. — Р. e51–e61. ссылка
- Juneja M., Burns J., Saporta M. A., Timmerman V. Challenges in modelling the Charcot-Marie-Tooth neuropathies for therapy development // J Neurol Neurosurg Psychiatry. — 2019. — № 1. — Р. 58–67. ссылка
- Brennan K. M., Bai Y., Shy M. E. Demyelinating CMT — what’s known, what’s new and what’s in store? // Neurosci Lett. — 2015. — Vol. 596. — P. 14–26. ссылка
- Shnayder N. A., Goncharova S. I. Role of stretch therapy in comprehensive physical habilitation of patients with Charcot-Marie-Tooth hereditary neuropathy // Neuromuscular Diseases. — 2015. — № 1. — Р. 35–41.
- Charcot-Marie-Tooth disease // Mayo Clinic. — 2023.
- Charcot-Marie-Tooth disease // National Health Service. — 2022.
- Neurotoxic medications // CMT United Kingdom. [Электронный ресурс]. Дата обращения: 07.09.2023.
- Exercise and General Health Tips // CMT United Kingdom. [Электронный ресурс]. Дата обращения: 07.09.2023.
- Benstead T. J., Grant I. A. Progress in clinical neurosciences: Charcot-Marie-Tooth disease and related inherited peripheral neuropathies // Can J Neurol Sci. — 2001. — № 3. — Р. 199–214.ссылка
- Шнайдер Н. А., Глущенко Е. В. Наследственная нейропатия — гетерогенная группа генетически детерминированных заболеваний периферической нервной системы // Вестник Клинической больницы № 51. — 2009. — № 4. — С. 17–22.
- Глущенко Е. В., Шнайдер Н. А., Козулина Е. А. Лечение и реабилитация больных наследственной нейропатией Шарко — Мари — Тута // Вестник новых медицинских технологий. — 2009. — № 2.
- Eichinger K. The Basics of Balance // CMTA. — 2014.
- Voet N. B., van der Kooi E. L., Riphagen I. I. et al. Strength training and aerobic exercise training for muscle disease // Cochrane Database Syst Rev. — 2010. — № 1.ссылка
- Skalsky A. G. Prevention and management of limb contractures in neuromuscular diseases // Phys Med Rehabil Clin Nam. — 2012. — № 3. — Р. 675–687.ссылка
- Kobesova A., Kolar P., Mlckova J. et al. Effect of functional stabilization training on balance and motor patterns in a patient with Charcot-Marie-Tooth disease // Neuroendocrinilogy Letters. — 2012. — № 1. — Р. 3–10.ссылка
- Ornstein H., Stilwell G. Charcot-Marie-Tooth and Your Feet // CMTA. — 2013.
- Pareyson D., Marchesi C. Diagnosis, natural history, and management of Charcot-Marie-Tooth disease // The Lancet. — 2009. — № 7. — Р. 654–667.ссылка