Дефект межпредсердной перегородки (Atrial septal defect) — это врождённый порок сердца, при котором в межпредсердной перегородке образуется отверстие. Через него кровь поступает из левого предсердия в правое, из-за чего сосуды лёгких получают больше крови, чем нужно.
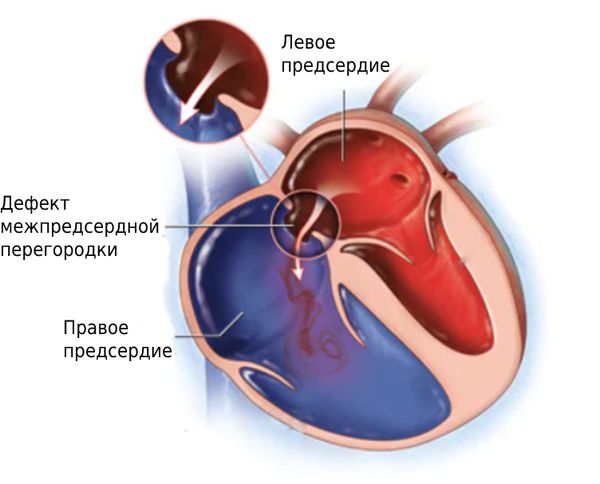
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) составляет примерно 7 % от всех врождённых пороков сердца и является одним из самых частых пороков у детей старше 3 лет .
ДМПП часто протекает бессимптомно, поэтому может долго оставаться незамеченным. У некоторых пациентов этот дефект может приводить к одышке и быстрой утомляемости при физической нагрузке. Также родители детей с ДМПП указывают на частые респираторные заболевания, умеренную задержку физического развития и повышенную потливость у ребёнка. С возрастом могут появиться жалобы на перебои в работе сердца (аритмии).
ДМПП могут различаться размерами, формой и расположением. Дефекты могут располагаться в разных отделах межпредсердной перегородки, а по размеру бывают как совсем маленькими, так и очень большими, вплоть до полного отсутствия перегородки, т. е. объединения двух предсердий в одно. Также у пациента может быть несколько ДМПП или этот дефект может сопровождать другие врождённые пороки сердца.
Причины дефекта межпредсердной перегородки
ДМПП формируется во время эмбрионального развития, поэтому в группу риска попадают генетически предрасположенные новорождённые, т. е. если у кого-то из близких кровных родственников был порок сердца. Также на формирование дефекта может повлиять:
- экология;
- инфекционные заболевания, сильный токсикоз, угроза выкидыша, сахарный диабет у матери во время беременности (в том числе гестационный СД);
- употребление наркотиков или алкоголя родителями ребёнка .
Открытое овальное окно и ДМПП: в чём разница
Иногда возникает путаница в определениях открытого овального окна и дефекта межпредсердной перегородки. Открытое овальное окно — это норма при внутриутробном развитии. По размеру оно не превышает 5–6 мм, размер ДМПП больше. Ребёнок рождается с этим отверстием, в норме оно должно закрыться в первый год жизни, но может остаться открытым до 5–6 лет, а у 20 % пациентов сохраняется на всю жизнь — в таком случае может потребоваться лечение .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы дефекта межпредсердной перегородки
ДМПП может долго протекать бессимптомно, а его проявления могут быть разнообразными, поэтому дефект часто не распознают сразу, а выявляют уже при выраженных симптомах либо в подростковом или взрослом возрасте. В первые месяцы жизни ДМПП может проявляться только утомляемостью и посинением носогубного треугольника при плаче младенца.
При небольшом дефекте (10–15 мм) симптомы проявляются ближе к 20–30 годам. До этого никаких жалоб или нарушения физического развития может не быть. У взрослого пациента может проявиться одышка, нарушение сердечного ритма (аритмия), посинение носогубного треугольника и других участков кожи .
При ДМПП повышен объём крови в малом круге кровообращения, из-за чего могут чаще возникать, дольше и тяжелее проходить респираторные заболевания: бронхит и пневмония, которые сопровождаются влажными хрипами, кашлем и одышкой. У детей школьного возраста ДМПП может проявляться склонностью к обморокам и головокружению, одышкой, быстрой утомляемостью при физических упражнениях и даже небольших нагрузках. На эти симптомы обычно указывают родители ребёнка.
При средних и больших дефектах симптомы могут ярко проявиться уже к полугоду и концу первого года жизни. На ДМПП будет указывать отставание в физическом развитии, бледность кожи, недостаточный набор веса, одышка и учащённое сердцебиение (тахикардия). Проявления сердечной недостаточности при ДМПП незначительны и могут ограничиваться умеренной слабостью, потливостью и бледностью кожи. В некоторых случаях со временем развивается лёгочная гипертензия, при которой повышено давление в лёгочной артерии. При больших дефектах (равных примерно половине от всей длины межпредсердной перегородки) увеличивается печень и появляются отёки ног.
Патогенез дефекта межпредсердной перегородки
Чтобы понять, как работает кровеносная система, рассмотрим циркуляцию крови в здоровом сердце.
Сердце разделено перегородками на четыре камеры: две правые — правое предсердие и правый желудочек, и две левые — левое предсердие и левый желудочек. Предсердия и желудочки соединены клапанами, которые регулируют ток крови из предсердия в желудочек.
Правое предсердие и желудочек собирают венозную кровь, которая поступает из всех органов и тканей. Она тёмно-бордового цвета, содержит мало кислорода и много углекислоты. Правый желудочек выталкивает эту кровь в лёгочную артерию, и вся венозная кровь поступает в артерии и капилляры лёгких, где методом диффузии насыщается кислородом и очищается от углекислоты. Кровь обогащается кислородом, становится более красной и поступает в левое предсердие по четырём лёгочным венам. На этом заканчивается малый круг кровообращения и начинается большой.
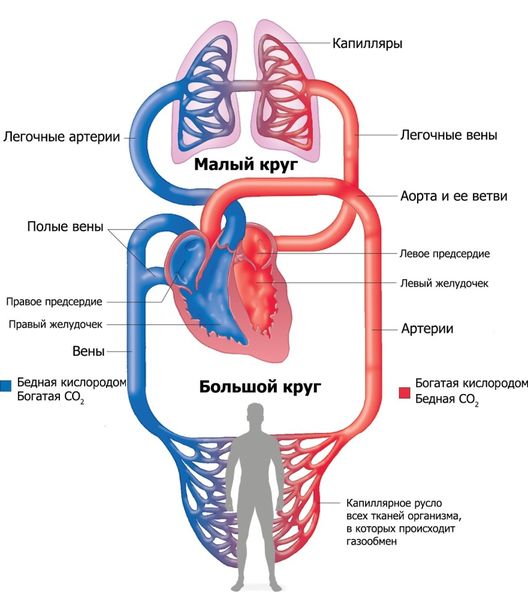
Большой и малый круг кровообращения
Из левого предсердия кровь поступает в левый желудочек, а оттуда после мощного сокращения расходится по аорте и её ответвлениям в органы и ткани. Когда кровь отдаст весь кислород органам, тканям и капиллярам, она снова станет венозной. Венозные капилляры соединяются в более толстые вены, которые в итоге образуют верхнюю и нижнюю полые вены. Верхняя полая вена переносит кровь от головы, рук и стенок туловища, а нижняя — от ног, органов брюшной полости и таза. Верхняя и нижняя полые вены приносят кровь в правое предсердие. На этом заканчивается большой круг кровообращения.
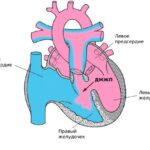
При ДМПП происходит избыточный сброс крови из левого предсердия в правое — через отверстие в перегородке кровь, насыщенная кислородом, находит дополнительный выход в правое предсердие. Малый круг кровообращения при этом перенасыщается кровью, что дополнительно нагружает правое предсердие и заставляет усиленно работать правый желудочек. При длительном переполнении кровью малого круга повышается давление в лёгочной артерии, из-за чего в пожилом возрасте может развиться обструктивная болезнь лёгочных сосудов, что может проявляться постоянной синюшностью кожи, даже в покое.
Классификация и стадии развития дефекта межпредсердной перегородки
Дефекты межпредсердной перегородки подразделяются:
- на открытое овальное окно;
- первичный и вторичный дефект межпредсердной перегородки;
- дефект венозного синуса: верхний и нижний;
- дефект коронарного синуса (обескрышенный коронарный синус).
Открытое овальное окно — это норма при внутриутробном развитии. Лёгкие у плода ещё не раскрыты и не работают, поэтому кровь проходит в овальное окно и замыкает малый круг кровообращения. В норме оно закрывается в первые 2–3 недели после рождения, но это может произойти и позже — в возрасте до 5–6 лет.
Если открытое овальное окно выявлено на УЗИ после этого возраста и сопровождается симптомами, то может потребоваться хирургическое вмешательство.
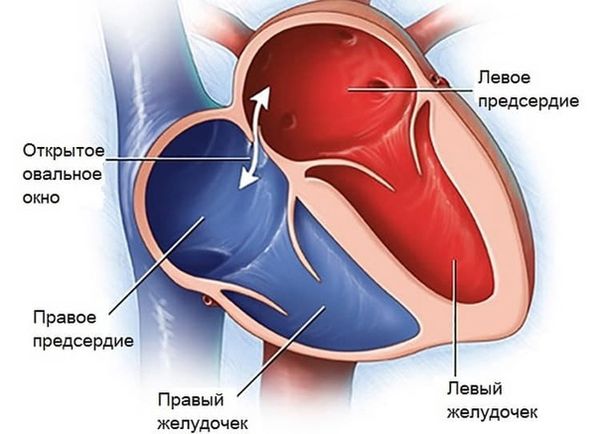
Открытое овальное окно
Первичный дефект возникает из-за недоразвития первичной перегородки у эмбриона (межпредсердная перегородка развивается в два этапа: сначала нарастает первый листок — первичная перегородка, потом параллельно ей растёт вторичная перегородка). Типичное расположение первичного дефекта — на уровне фиброзного кольца атриовентрикулярных клапанов. Фиброзные кольца митрального и трикуспидального клапанов становятся нижней стенкой дефекта. Дефект иногда сочетается с другими пороками, такими как расщепление митрального или трикуспидального клапанов и атриовентрикулярным каналом. В таких случаях признаки сердечной недостаточности проявятся раньше и пациентам потребуется консервативная терапия либо ранняя коррекция порока.
Вторичный дефект чаще всего встречается среди врождённых пороков сердца. Он возникает из-за нарушений развития вторичной перегородки у эмбриона. Такой дефект легче всего переносится пациентом.
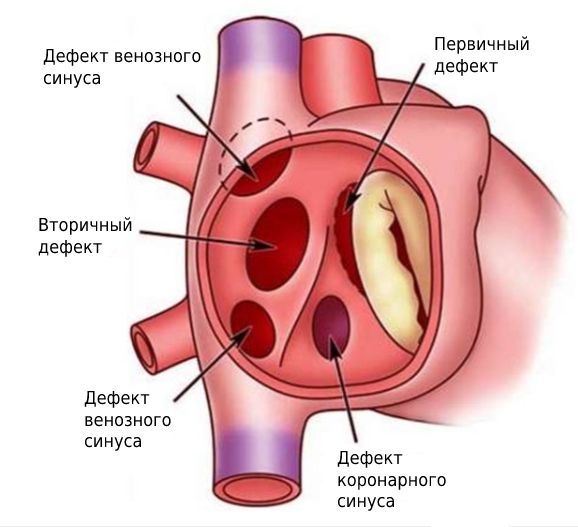
Виды ДМПП
Дефект венозного синуса расположен на задней стороне перегородки возле верхней или нижней полой вены. Он часто связан с аномальным возвратом крови из правой верхней или нижней лёгочной вены в правое предсердие или полую вену. Кровообращение при таком дефекте примерно такое же, как при больших ДМПП. При лечении, помимо устранения дефекта, ещё выполняется коррекция аномального дренажа лёгочных вен — врождённого порока, при котором одна или несколько лёгочных вен впадают в правое предсердие, либо в полые вены, либо в их основные ветви.
Дефект коронарного синуса (обескрышенный коронарный синус) — это дефект стенки коронарного синуса, при котором происходит сброс крови из левого предсердия в коронарный синус, а затем в правое предсердие. Такой дефект часто протекает бессимптомно. Составляет 10 % от всех вариантов ДМПП . При наличии значимого сброса крови через дефект устраняется только хирургическим путём.
При выявлении любого типа ДМПП проводится дополнительное обследование и может потребоваться хирургическое лечение .
Осложнения дефекта межпредсердной перегородки
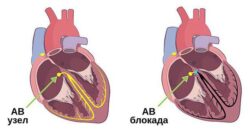
При длительно существующем ДМПП может возникнуть аритмия, при которой спонтанно на некоторое время учащается сердцебиение, затем ритм также внезапно снова становится нормальным. Также может возникнуть трепетание предсердий, что сопровождается частым регулярным ритмом, из-за чего ухудшается общее самочувствие, повышается утомляемость, появляется одышка и непереносимость физической нагрузки. Кроме того, может развиться фибрилляция предсердий, при которой сердце сокращается то быстрее, то медленнее, что также доставляет беспокойство пациенту. В основном все эти симптомы появляются после 20–40 лет .
В дальнейшем из-за постоянного повышения давления и сопротивления в лёгочной артерии кровь протекает как в соседнее предсердие, так и обратно, что сопровождается синдромом Эйзенменгера. При этом осложнении возникает нехватка кислорода, могут быть обмороки, повышенная утомляемость, головокружение, одышка, боль в груди, синюшность кожи и слизистых (эти признаки могут быть как в покое, так и при физической нагрузке). При развитии этого осложнения необходимо как можно скорее лечь в стационар на обследование, так как состояние опасно для жизни.
Диагностика дефекта межпредсердной перегородки
При диагностике ДМПП проводится сбор анамнеза (истории болезни), аускультация (выслушивание сердца), электрокардиография (ЭКГ) и эхокардиография (ЭхоКГ).
Сбор анамнеза
При обследовании ребёнка врач уточняет у родителей, были ли врождённые пороки сердца у ближайших родственников и как протекала беременность у матери. Также он спрашивает об одышке, сбоях ритма сердца, утомляемости и частых заболеваниях у ребёнка. Медленный набор веса тоже является симптомом ДМПП.
Аускультация сердца
Первый и самый простой метод — это выслушивание сердца. Врач может услышать шумы и сбой ритма и назначить инструментальное обследование, чтобы подтвердить диагноз.
Инструментальная диагностика
- Электрокардиография (ЭКГ) — показывает отклонения в частоте и регулярности сокращений сердца, позволяет диагностировать аритмию и перегрузку правого предсердия и желудочка.
- Эхокардиография (ЭхоКГ) — ультразвуковой метод, позволяющий выявить точное расположение дефекта и изменение камер сердца, чтобы определиться с тактикой лечения. С помощью цветной допплерографии определяют сброс крови и вычисляют систолическое давление в правом желудочке. Эхокардиография также помогает выявить дополнительные пороки, определить вид ДМПП, направление сброса крови и соотношение лёгочного и системного кровотока (Qp/Qs). Разновидностью эхокардиографии является чреспищеводная ЭхоКГ. Она проводится у взрослых пациентов, чтобы уточнить информацию о расположении и краях дефекта, что в дальнейшем помогает подобрать подходящий метод лечения.
- Рентгенография органов грудной клетки показывает деформацию ствола лёгочной артерии, гипертрофию сердца и усиление лёгочного рисунка.
ЭхоКГ
Если перечисленных методов недостаточно для получения полной информации о дефекте и выбору метода лечения, проводится зондирование камер сердца — исследование его камер и ближайших больших сосудов с помощью катетера.
На основе проведённых исследований кардиолог, кардиохирург и врачи других специальностей (если это необходимо) подбирают метод лечения дефекта, в том числе оперативный .
Дифференциальная диагностика
Симптомы ДМПП похожи на многие дефекты с перенасыщением малого круга кровью (гиперволемией), поэтому только по клинической картине этот порок нельзя отличить от других заболеваний. Определить тип порока врач может после проведения ЭхоКГ.
Лечение дефекта межпредсердной перегородки
При небольших ДМПП обычно нет симптомов и не требуется терапия. Пациенты наблюдаются у кардиолога по месту жительства и проходят ЭхоКГ не реже одного раза в год .
При большом дефекте, приводящем к изменению кровотока, возможно только хирургическое лечение. При значимых дефектах показанием к коррекции является гиперволемия малого круга кровообращения и риск развития лёгочной гипертензии.
Выбор метода зависит от вида и свойств дефекта, а также от наличия сопутствующих врождённых пороков сердца. При симптомах сердечной недостаточности сперва может быть назначено консервативное лечение.
Суть любого метода лечения состоит в закрытии дефекта. После сбора анамнеза и обследования врач может назначить лечение одним из перечисленных методов:
- Классический метод — открытая операция с доступом к сердцу через грудину. Проводится с подключением аппарата искусственного кровообращения, сердце при этом кровью не снабжается. Дефект ушивается, если это возможно, если нет — накладывается заплата, чаще из бычьего перикарда . После операции пациент восстанавливается примерно 7–10 дней.
- Миниинвазивная операция через боковую торакотомию по средней подмышечной линии — это щадящая открытая операция с небольшим доступом (4–6 см) на правой стороне грудной клетки. Отличается от классического метода быстрым восстановлением (5–7 дней) и менее заметным рубцом .
- Робот-ассистированное торакоскопическое вмешательство — операция, которая проводится хирургическим комплексом Da Vinci с помощью нескольких проколов грудной клетки. Этот метод позволяет пациенту восстановиться быстрее, чем при классической операции (примерно через 4–5 дней) . Однако комплекс Da Vinci есть не во всех центрах и, учитывая высокую стоимость такого лечения, предпочтение обычно отдаётся транскатетерному способу закрытия дефекта.
- Эндоваскулярное вмешательство — проводится через прокол в бедренной вене с помощью системы специальных внутрисосудистых устройств (катетеров). Через эту систему в дефект устанавливают окклюдер — специальное устройство в виде «зонтика» или «шпульки», которое в сложенном состоянии проводится до дефекта и раскрывается по типу зонтика, закрывая отверстие. Эндоваскулярное вмешательство выполняется под рентгенологическим контролем и не требует общего наркоза . Примерно 70–80 % изолированных вторичных ДМПП могут быть закрыты этим способом. Восстановление после операции проходит достаточно быстро: через 1–3 дня пациент может быть выписан из стационара.
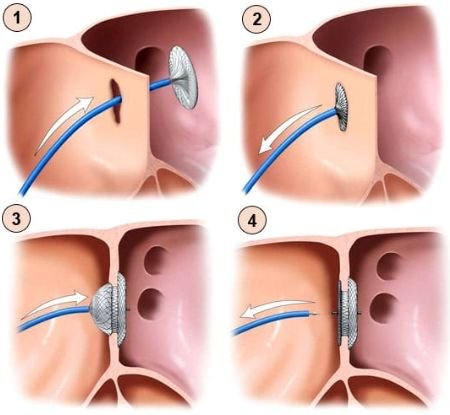
Установка окклюдера
Показания и противопоказания к операциям
Открытая операция противопоказана при малом диаметре дефекта, тяжёлой стадии лёгочной гипертензии, смене направления сброса через дефект, дополнительных нарушениях в малом и большом кругах кровообращения.
Для эндоваскулярного вмешательства противопоказанием является ДМПП с частичным дренажем лёгочных вен, дефекты большого размера (более 4–5 см) или без нижнего края. Если ДМПП сочетается с другими патологиями, требуется классическая открытая операция.
В каждом конкретном случае происходит коллегиальная оценка и определяется оптимальный способ коррекции, с учётом всех особенностей пациента. Подробнее о показаниях и противопоказаниях лечащий врач расскажет во время консультации и обследования.
Реабилитация и диспансерное наблюдение после хирургического лечения
Если после операции сохранилась остаточная лёгочная гипертензия и/или есть признаки недостаточности кровообращения, пациенту рекомендуется в течение трёх месяцев пройти восстановительное лечение в кардиологическом санатории или реабилитационном центре.
После операции кардиолога нужно посетить через месяц, полгода и год. Диспансерное наблюдение включает ЭКГ, ЭхоКГ и при необходимости тесты с дозированной физической нагрузкой и пульсоксиметрию. Дальнейшее наблюдение при наличии показаний проводится с интервалом 12 месяцев и больше .
После установки окклюдера рекомендуется пройти ЭхоКГ, чтобы определить положение устройства и исключить осложнения. ЭхоКГ в таком случае выполняется через 24 часа после операции, затем через месяц, полгода и год с последующими регулярными обследованиями, назначенными лечащим врачом.
После транскатетерного закрытия ДМПП рекомендуется в течение шести месяцев применять ингибиторы агрегации тромбоцитов.
Прогноз. Профилактика
Примерно 15–30 % вторичных ДМПП размером до 6 мм спонтанно закрываются в раннем детстве . Если к 5–6-летнему возрасту этого не происходит, рекомендуется проконсультироваться с кардиохирургом, чтобы определить сроки и подобрать метод оперативного лечения. Лучше всего дети восстанавливаются при операции, перенесённой в возрасте от 2 до 6 лет. Продолжительность жизни пациентов после коррекции ДМПП такая же, как и у остальных людей.
Вторичный ДМПП протекает благоприятно до 20–30 лет, но без лечения средняя продолжительность жизни составляет 36–40 лет.
Пациентам с ДМПП (оперированным или нет) нужно всю жизнь периодически посещать кардиолога.
Малые дефекты, которые, тем не менее, не закрылись в детстве, во взрослом и пожилом возрасте могут проявляться симптомами. Поэтому обследование сердца нужно проводить на первом году жизни ребёнка вне зависимости от предрасположенности к ДМПП .
Список литературы
- Ассоциация сердечно-сосудистых хирургов России. Дефект межпредсердной перегородки: клинические рекомендации. — М., 2020. — 34 с.
- Зиньковский М. Ф. Врождённые пороки сердца. — Киев: Книга плюс, 2009. — 1169 с.
- Хапаев Т. С., Архипов А. Н., Омельченко А. Ю. и др. Закрытие дефектов межпредсердной перегородки из мидаксиллярной боковой миниторакотомии в условиях индуцированной фибрилляции желудочков // Патология кровообращения и кардиохирургия. — 2015. — № 2. — С. 15–19.
- Архипов А. Н., Зубрицкий А. В., Богачев-Прокофьев А. В., Караськов А. М. Первый успешный клинический случай полностью эндоскопического закрытия дефекта межпредсердной перегородки с использованием хирургического комплекса da Vinci // Патология кровообращения и кардиохирургия. — 2015. — № 3. — С. 123–127.
- Yang X., Wang D., Wu Q. Repair of atrial septal defect through a minimal right vertical infra-axillary thoracotomy in a beating heart // Ann Thorac Surg. — 2001. — № 1. — P. 2053–2054.ссылка
- Schreiber C., Bleiziffer S. Minimally invasive midaxillary muscle sparing thoracotomy for atrial septal defect closure in prepubescent patients // Ann Thorac Surg. — 2005. — № 2. — P. 673–677. ссылка
- Spadaro J., Bing O. H., Gaasch W. H. et al. Effects of perfusion pressure on myocardial performance, metabolism, wall thickness and compliance: comparison of the beating and fibrillating heart // J Thorac Cardiovasc Surg. — 1982. — № 3. — P. 398–405. ссылка
- Кривощеков Е. В., Ковалев И. А., Шипулин В. М. Врождённые пороки сердца: справочник для врачей. — Томск, 2009. — 289 с.
- Бокерия Л. А., Беришвили И. И. Хирургическая анатомия сердца. Том 3. — М.: Издательство НЦССХ им. А. Н. Бакулева РАМН, 2006.
- Джонас Р. А. Хирургическое лечение врождённых пороков сердца / под ред. М. В. Борискова. — М.: ГЭОТАР-Медиа, 2017. — 736 с.
- Faccini A., Butera G. Atrial septal defect (ASD) device trans-catheter closure: limitations // J Thorac Dis. — 2018. — P. S2923–S2930. ссылка
- Ассоциация сердечно-сосудистых хирургов. Национальные рекомендации по ведению детей с врождёнными пороками сердца. — М., 2014. — 356 с.
- Giblett J. P., Abdul-Samad O., Shapiro L. M. et al. Patent Foramen Ovale Closure in 2019 // Interv Cardiol. — 2019. — № 1. — Р. 34–41.ссылка