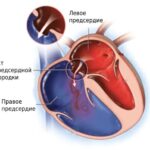
Дефект межжелудочковой перегородки (ДМЖП; Ventricular septal defect) — это один из врождённых пороков сердца, при котором внутриутробно нарушается формирование перегородки между правым и левым желудочками. Из-за этого они начинают сообщаться между собой, что в дальнейшем может привести к развитию сердечной недостаточности .
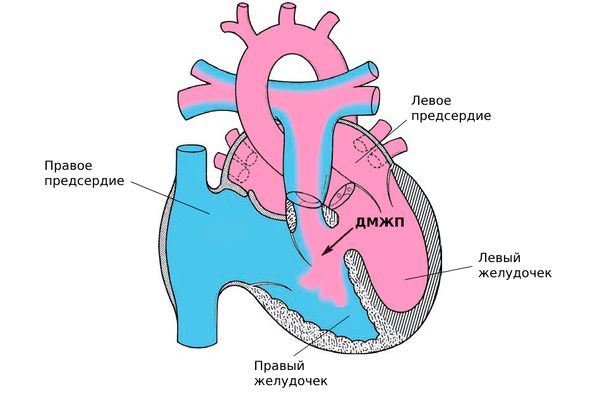
Дефект межжелудочковой перегородки [23]
Формирование сердца с крупными сосудами происходит с 3-й по 8-ю неделю беременности, а непосредственно разделение желудочков перегородкой — примерно с 32–33-го по 62–63-й дни . Отсчёт ведётся со дня оплодотворения яйцеклетки.
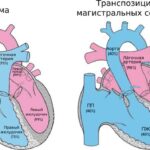
ДМЖП может встречаться как изолированно, так и в структуре более сложных пороков сердца, например тетрады Фалло или двойного отхождения магистральных сосудов от правого желудочка. При тетраде Фалло дети без ДМЖП могут выжить, тогда как при двойном отхождении дефект является единственным отверстием для оттока крови из левого желудочка, поэтому необходим для выживания ребёнка.
Распространённость ДМЖП
Не считая двухстворчатого аортального клапана, ДМЖП является самым распространённым врождённым пороком сердца (20–30 % от всех пороков). У мальчиков и девочек он встречается примерно с одинаковой частотой .
Поскольку это врождённый порок сердца, то чаще его выявляют в детском возрасте. Вообще ДМЖП, как правило, диагностируют в младенчестве, и чем старше ребёнок, тем меньше вероятность, что этот порок будет обнаружен, так как некоторые небольшие дефекты закрываются спонтанно .
Причины ДМЖП
Чётких факторов риска нет, но ДМЖП чаще встречается у детей, чьи кровные родственники имеют врождённые пороки сердца . Доказано, что в семьях, где у близких родственников выявлен ДМЖП (в том числе любой сложный врождённый порок сердца, который включает в себя ДМЖП), риск развития порока у ребёнка немного выше, чем в здоровой популяции . При этом наличие изолированного дефекта межпредсердной перегородки или открытого артериального протока не повышает риск развития ДМЖП у родственников.
К формированию любого врождённого порока сердца, в том числе и ДМЖП, также могут привести:
- вредные привычки матери, такие как курение, употребление алкоголя и наркотических веществ, во время беременности;
- инфекционные заболевания матери во время беременности, в особенности вирусные (краснуха, ветряная оспа и др.);
- воздействие вредных факторов окружающей среды в первом триместре.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы дефекта межжелудочковой перегородки
Клиническая картина ДМЖП зависит в первую очередь от размеров самого дефекта: чем он больше, тем более выраженными будут симптомы.
Как правило, при очень больших дефектах, когда между желудочками нет разницы давления, при аускультации (выслушивании) шума практически не слышно. Но родители могут обратить внимание на то, что ребёнок стал реже есть, так как ему становится труднее дышать во время грудного вскармливания, на время перестаёт сосать, чтобы отдышаться, или сосёт медленнее, а также сильнее потеет во время кормления . Все эти симптомы — проявления развивающейся сердечной недостаточности, т. е. признаки развития осложнений, а не самого ДМЖП: симптомом дефекта является только отсутствие или нарушение шума, а все остальные признаки вызваны уже сердечной недостаточностью. Если появились подобные симптомы, нужно незамедлительно обратиться к педиатру и выполнить эхокардиографию .
Небольшие дефекты имеют другую клиническую картину — как правило, очень невыраженную, и единственным признаком порока сердца будет служить сильный шум в сердце. Если шум достаточно грубый, его можно услышать без фонендоскопа; также иногда может быть систолическое дрожание грудной клетки в области сердца; и то и другое родители могут заметить самостоятельно. В любом случае, как только появились какие-либо подозрения на наличие врождённого порока сердца, нужно незамедлительно обратиться к врачу и выполнить эхокардиографию, чтобы понять, что же не так с сердцем малыша.
Патогенез дефекта межжелудочковой перегородки
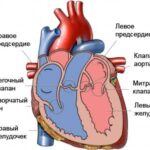
В здоровом сердце четыре камеры: правые предсердие и желудочек и левые предсердие и желудочек. В правых отделах собирается бедная кислородом кровь, которая затем через лёгочную артерию попадает в лёгкие и обогащается кислородом. Далее она притекает в левые отделы, которые через аорту — самый большой и главный сосуд в организме человека — разносят богатую питательными веществами и кислородом кровь по всему организму. Такой цикл повторяется с момента рождения и до смерти человека.
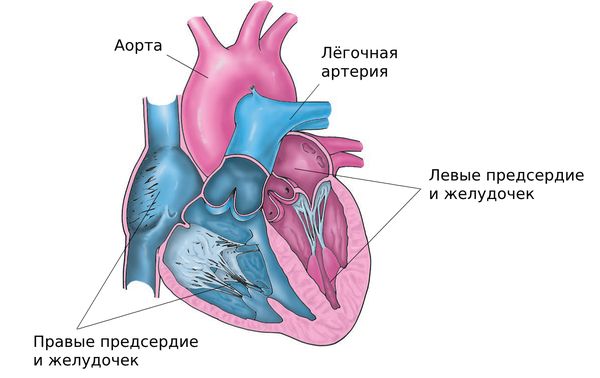
Строение сердца
У ребёнка в утробе матери лёгкие минимально участвуют в кровообращении и совсем не выполняют свою основную функцию — газообмен. Мама в данном случае «дышит за двоих»: от неё к плоду поступает богатая кислородом кровь. Так как плод не дышит, лёгкие сжаты, и, соответственно, в сосудах лёгких повышено сопротивление. Поэтому также повышено и давление в правом желудочке, оно примерно равно давлению в левом желудочке, из-за этого сброс крови по дефекту межжелудочковой перегородки не происходит.
Когда ребёнок рождается и делает первый вдох, лёгкие расправляются, и в них начинает снижаться сосудистое сопротивление . После этого правому желудочку больше нет необходимости нагнетать большое давление, чтобы выбросить кровь, поэтому оно начинает падать. Появляется разница (градиент) давления между левым и правым желудочками. В результате часть богатой кислородом крови, которая в норме должна была попасть в аорту, при ДМЖП утекает в правый желудочек и снова в лёгкие. Тем самым лёгочный кровоток перегружается дополнительным объёмом крови.
Как уже говорилось выше, чем больше размер дефекта, тем больше сброс, и, соответственно, тем сильнее перегрузка лёгких кровью. Какое-то время сосуды лёгких способны вмещать дополнительный объём крови без каких-либо последствий. Но спустя время в их стенке начинают происходить определённые изменения, более подробно обсудим их в разделе «Осложнения».
Классификация и стадии развития дефекта межжелудочковой перегородки
Основная классификация ДМЖП касается их положения в самой перегородке. Эта классификация имеет значение для детского кардиолога и кардиохирурга, так как положение дефекта влияет на выбор вида лечения и особенности оперативного вмешательства.
В основном выделяют четыре вида дефектов:
- по типу атриовентрикулярного канала (в русскоязычной литературе — приточные);
- мышечные (подразделяются на задние, средние, передние и верхушечные);
- коновентрикулярные (сюда относятся наиболее часто встречающиеся мембранозные дефекты, а также дефекты в структуре более сложных пороков сердца, таких как тетрада Фалло или перерыв дуги аорты с дефектом межжелудочковой перегородки);
- дефекты конусной перегородки (в русскоязычной литературе — отточные, или подлёгочные) .
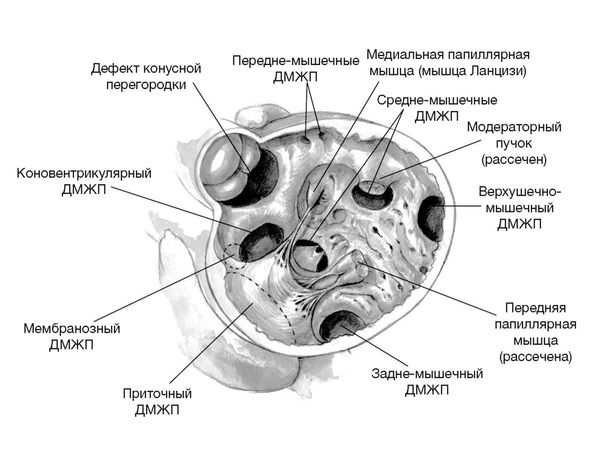
Виды дефектов межжелудочковой перегородки [21]
Чаще всего встречаются коновентрикулярные мембранозные дефекты, они составляют до 70–80 % всех ДМЖП. Аортальная недостаточность чаще развивается при дефекте конусной перегородки, чуть реже при коновентрикулярных дефектах; дефекты по типу АВ-канала могут сочетаться со страддлингом трикуспидального или митрального клапана, что практически никогда не позволяет хирургам выполнить анатомическую коррекцию . Страддлинг — это прикрепление папиллярных мышц в «неправильном желудочке», т. е. папиллярных мышц митрального клапана в правом желудочке, или папиллярной мышцы трикуспидального клапан в левом.
Существует дополнительный подвид дефектов, которые называются Swiss cheese — «швейцарский сыр». Это множественные дефекты, как правило мышечные (или сочетание нескольких видов), которые требуют особого подхода к лечению.
Относительно течения заболевания больший интерес представляет гемодинамическая классификация, которая отражает величину сброса крови и определяет, насколько будут выражены симптомы.
Согласно этой классификации, выделяют два вида дефектов:
- маленькие дефекты — как правило, не вызывают симптомов и могут выявляться случайно во время планового осмотра у детского кардиолога в возрасте одного месяца;
- большие дефекты — практически всегда вызывают выраженные симптомы у младенцев, из-за чего родители обращаются к педиатру.
Отнесение дефекта к большим или маленьким зависит от веса ребёнка: если младенец весит 2 кг, то для него и дефект в 4 мм может быть сильно значимым, а если весит 4 кг, то и 6 мм может быть абсолютно бессимптомным; для среднестатистического ребёнка (~3,2–3,5 кг) дефект свыше 6–7 мм уже значим.
Стадии ДМЖП
Можно выделить три стадии:
- Компенсации — организм малыша полностью компенсирует изменения, которые происходят в гемодинамике (движении крови по сосудам), каких-либо жизнеугрожающие состояния не возникают.
- Субкомпенсации — начинают проявляться первые симптомы сердечной недостаточности в виде одышки и избыточной потливости при кормлении.
- Декомпенсации — проявляются более грубые нарушения, а именно отсутствие прибавки в весе, одышка в покое, беспокойство и плохой сон.
Если достаточно крупные дефекты (более 8–10 мм) не лечить хирургически, то через какое-то время они вызовут необратимые изменения в сосудах лёгких, которые называются синдромом Эйзенменгера. При этом синдроме сопротивление в сосудах лёгких повышается настолько, что давление в правом желудочке становится выше давления в левом, и сброс меняет своё направление. Оперативное лечение к этому моменту уже противопоказано . При развитие синдрома Эйзенменгера показана только медикаментозная терапия ЛАГ-специфическими препаратами (Бозентан, Илопрост и т. д.).
Осложнения дефекта межжелудочковой перегородки
Основное и наиболее распространённое осложнение — это необратимая лёгочная гипертензия, или синдром Эйзенменгера. Заболевание развивается из-за длительной перегрузки сосудов лёгких дополнительным объёмом крови и повышенным давлением (при ДМЖП). Стенки сосудов долгое время испытывают чрезмерное растяжение, поэтому претерпевает необратимые изменения — теряют эластичность и становятся жёсткими, как металлическая труба.
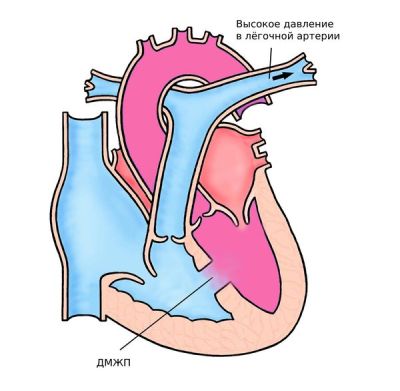
Синдром Эйзенменгера
К симптомам синдрома Эйзенменгера относят цианоз (синюшность кожи), обмороки, одышку, утомляемость, боль в груди, усиленное сердцебиение, а также кровохарканье, но оно развивается позднее всего . Если дополнительный объём крови большой, без рестрикции, то этот синдром может развиться и на первом году жизни; а если он хотя бы с какой-то рестрикцией, то для его развития может потребоваться не один десяток лет . Рестриктивным называют маленький дефект с высоким градиентом давления, при нерестриктивном дефекте давление в желудочках равное.
Также к осложнениям относят инфекционный эндокардит левых отделов сердца и недостаточность аортального клапана из-за того, что одна из створок пролабирует (проваливается) в дефект.
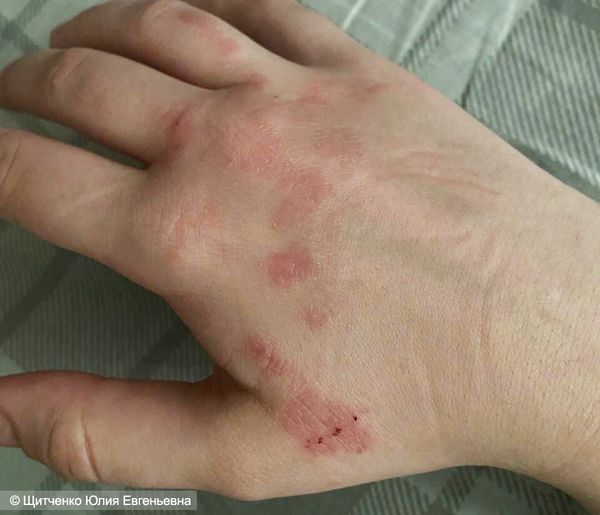
Инфекционный эндокардит может возникнуть при любом из видов ДМЖП независимо от размеров дефекта, пола ребёнка, возраста и т. д. При этом осложнении примерно у 90 % пациентов повышается температура (чаще до 37,1–38,0 °C). Может появиться общая слабость, пропасть аппетит, снизиться вес, а также могут появиться симптомы, однозначно указывающие на это заболевание: узелки Ослера (болезненные подкожные узелки, обычно на подушечках пальцев), очаги Джейнуэя (безболезненные пятна на ладонях и подошвах) и пятна Рота (кровоизлияния в сетчатку глаза с белыми участками в центре) . При эндокардите также бывают эмболические осложнения (закупорка сгустками артерий, идущих как к лёгким, так и к мозгу).
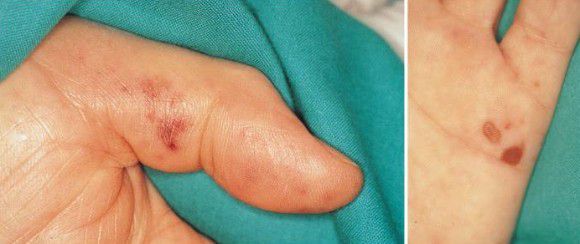
Узел Ослера (слева) и очаг Джейнуэя (справа) [22]
Недостаточность аортального клапана больше характерна для коновентрикулярных дефектов и дефектов конусной перегородки . Основным симптомом при этом будет диастолический шум в точке аускультации аортального клапана, также может появиться симптом Мюссе — покачивание головы в такт сердечным сокращениям; «пляска каротид» — видимая пульсация общих сонных артерий; большая разница между систолическим (верхним) и диастолическим (нижним) давлением.
Диагностика дефекта межжелудочковой перегородки
Диагностика дефектов межжелудочковой перегородки сводится к сбору анамнеза (истории болезни), аускультации (выслушиванию), электрокардиографии и эхокардиографии. Иногда, если необходимо количественно оценить величину лёгочного сосудистого сопротивления, применяется ангиография или зондирование полостей сердца.
Сбор анамнеза
На приёме врач спросит, как протекала беременность, сталкивалась ли мать с влиянием каких-либо вредных факторов (например, проживание вблизи вредных производств, курение и приём алкоголя в первые восемь недель беременности), имелись ли у кого-то из родителей в роду врождённые пороки сердца.
Аускультация
При аускультации в зависимости от того, насколько выражен градиент давления между желудочками, будет выслушиваться систолический шум разной интенсивности. При небольших дефектах с высоким градиентом давления выслушивается грубый шум (иногда его называют «машинным») над всей областью сердца. При больших дефектах, когда давление в желудочках практически одинаковое, шум будет намного менее интенсивным .
Электрокардиография и эхокардиография
Определённые изменения на электрокардиограмме могут натолкнуть врача на мысль о необходимости проведения эхокардиографии. К таким изменениям может относиться отклонение оси сердца влево с признаками перегрузки его левого отдела .
Эхокардиография является оптимальным методом диагностики большинства врождённых пороков сердца, в том числе и дефектов межжелудочковой перегородки. Она позволяет точно определить размер, местоположение и количество дефектов, а также оценить величину сброса по соотношению лёгочного кровотока к системному (Qp/Qs) .
В большинстве случаев этих исследований бывает достаточно, чтобы определить, есть ли у малыша показания к оперативному лечению или нет.
Зондирование полостей сердца
Иногда необходимо выполнить зондирование полостей сердца, чтобы количественно оценить величину лёгочного сосудистого сопротивления, и только после этого исследования делать выбор в пользу какого-либо из методов лечения .
Дифференциальная диагностика
Дифференциальная диагностика при ДМЖП чаще проводится внутри самого диагноза — определяется локализация, размеры и количество дефектов. Также необходимо отличать врождённый дефект межжелудочковой перегородки от приобретённого (возникшего в результате внешней травмы или инфаркта миокарда с вовлечением межжелудочковой перегородки). Стоит отметить, что подобные состояния более характеры для взрослых . Например, в течение недели после инфаркта, как правило, у 1–4 % пациентов развивается дефект межжелудочковой перегородки .
Лечение дефекта межжелудочковой перегородки
Основной метод лечения ДМЖП — это операция. Так как подавляющее большинство дефектов являются коновентрикулярными (мембранозными), то и операции в основном выполняются открытым способом.
Показания к операции
Показанием к закрытию дефектов межжелудочковой перегородки являются признаки сердечной недостаточности и перегрузки левых отделов сердца у малышей первых шести месяцев жизни.
Если признаков сердечной недостаточности нет, то врачи количественно оценивают соотношение лёгочного и системного кровотока (Qp/Qs). Когда этот показатель больше 1,5, то показано оперативное вмешательство. Если же показатель меньше 1,5, тогда дефект не вызывает каких-либо значимых изменений гемодинамики и проводится наблюдение. Дефекты (чаще мышечные) могут самостоятельно закрыться или уменьшиться. Однако бывает, что в течение наблюдения развивается одно из осложнений (аортальная недостаточность либо инфекционный эндокардит) — это тоже будет показанием для оперативного лечения. При эндокардите перед операцией может потребоваться лечение антибиотиками или противогрибковыми препаратами, чтобы устранить воспаление. Если показаний к операции по инфекционному эндокардиту нет («левосторонние» вегетации больше 10 мм или критические проблемы с каким-либо из клапанов), то в первую очередь проводится антибиотикотерапия — эмпирическая, т. е. антибиотиками широкого спектра до получения результатов анализов, или по посевам.
До операции младенцы должны проходить обследование каждый месяц до года, если показания к хирургическому лечению не возникнут раньше; после года кратность обследований постепенно снижается до одного раза в год.
Операции открытым доступом
Оперативные вмешательства, как правило, выполняются доступом через грудину. Во время основного этапа операции функции сердца и лёгких берёт на себя специальная машина — аппарат искусственного кровообращения. Дефекты закрываются заплатой, чаще из бычьего перикарда, но также возможно использование синтетического материала. Восстановление после хирургического лечения сильно зависит от того, в каком состоянии пациент подошёл к операции. В среднем реабилитация в стационаре занимает до 10–14 дней. После операции осмотры проводятся сначала через месяц, затем через 3, 6, 12 месяцев и далее каждый год, если не появляются какие-либо жалобы.
Эндоваскулярные операции
При эндоваскулярных операциях дефект закрывается специальным устройством, которое доставляется по проводнику через бедренную вену, т. е. при этом не нужно вскрывать грудную клетку. Однако у этого метода есть некоторые ограничения: расположение дефекта и вес пациента. Такие операции обычно проводятся только при мышечных дефектах в средней трети перегородки; в некоторых странах выполняют подобные операции и при мембранозных дефектах, иногда даже с хорошими результатами, но у нас пока такие случаи единичны. Также есть ограничение по весу ребёнка, чтобы без последствий для его бедренной вены ввести в неё катетер, так как доставочные устройства большие. На сайте фирмы Abbot (производитель устройств Amplatzer) написано, что у пациентов весом менее 5,2 кг были плохие результаты, поэтому таким детям не рекомендуется эндоваскулярная операция. Там же сказано, что она противопоказана пациентам, у которых расстояние от края дефекта до клапанов менее 4 мм .
На практике эта методика применяется не очень часто, так как подавляющее большинство дефектов мембранозные (имеют края на кольце аортального и трикуспидального клапана). На оставшиеся, подходящие для эндоваскулярного закрытия дефекты приходится не так много операций.
Операции при дефектах по типу swiss cheese
При дефектах по типу «швейцарского сыра» сразу закрыть все дефекты у малыша первого года жизни достаточно трудно. Операции при таких дефектах длительны и травматичны для сердца, поэтому у детей этого возраста после первично-радикальной коррекции ДМЖП по типу swiss cheese плохие показатели выживаемости. Когда ребёнок прибавляет в весе, упрощается как работа внутри сердца (поиск всех дефектов и их качественное закрытие), так и выхаживание после операции.
Существует методика двухэтапной коррекции, когда сначала выполняется операция по сужению лёгочной артерии. Для этого используется специальная полоска из синтетической ткани — манжета. Цель такой операции — снизить перегрузку сосудов лёгких дополнительным объёмом крови и не допустить развития сердечной недостаточности. Когда ребёнок подрастёт и прибавит в весе, манжету удаляют и одномоментно закрывают множественные дефекты.
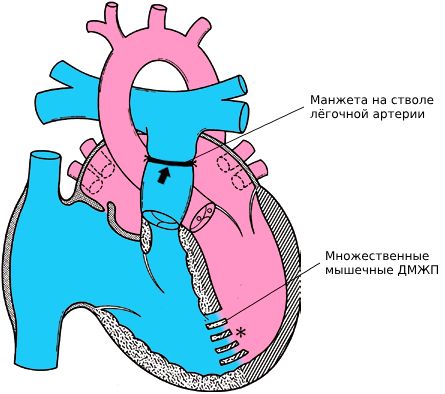
Сердце с множественными мышечными ДМЖП после суживания лёгочной артерии
Осложнения после операции
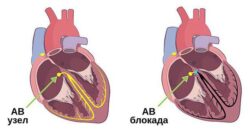
Возможные осложнения чаще всего связаны непосредственно с самим вмешательством. После операции может развиться временная или стойкая атриовентрикулярная блокада, которая потребует установки электрокардиостимулятора. Также существует риск развития дисфункции клапанов (чаще аортального или трёхстворчатого) в результате наложения заплаты или установки окклюдера .
Если возможна пластическая операция, то при развитии дисфункции клапанов в детском возрасте ей всегда отдаётся предпочтение; если же нет, то проводится разного рода протезирование клапанов — механические/биологические протезы, аутографты (операция Росса).
Прогноз. Профилактика
Небольшие дефекты в 20–30 % случаев склонны закрываться самостоятельно. Некоторые относительно большие дефекты также могут спонтанно закрыться или уменьшиться. Если ДМЖП не закрывается, но и не вызывает серьёзных нарушений гемодинамики, требуется периодическое наблюдение (для детей старше года при отсутствии жалоб — раз в год) .
Летальность во время или после операции составляет менее 1 %. После хирургического лечения продолжительность и качество жизни пациентов такие же, как и у здоровых людей .
Специфической профилактики врождённых пороков сердца не существует. Здоровье матери, отказ от вредных привычек, избегание опасных факторов окружающей среды и вирусных инфекций — все рекомендации носят неспецифический характер, даже соблюдение всего этого не может гарантировать 100%-й результат.
Список литературы
- Ассоциация сердечно-сосудистых хирургов России. Дефект межжелудочковой перегородки: клинические рекомендации МЗ РФ. — М., 2021. — 58 с.
- Hoffman J. I., Kaplan S. The incidence of congenital heart disease // J Am Coll Cardiol. — 2002. — № 12. — Р. 1890–1900. ссылка
- Schoenwolf G. C., Bleyl S. B., Brauer P. R., Francis-West P. H. Larsen’s human embryology. — 5th edition. — Elsevier Health Sciences, 2015. — P. 288–290.
- Шарыкин А. С. Врождённые пороки сердца: руководство для педиатров, кардиологов, неонатологов. — 2-е издание. — М.: Теремок, 2009. — 384 с.
- Бокерия Л. А., Гудкова Р. Г. Сердечно-сосудистая хирургия — 2021. Болезни и врождённые аномалии системы кровообращения. — М., 2022. — С. 133–189.
- Wernovsky G., Anderson R. H., Krishna К. et al. Anderson’s Pediatric Cardiology. — 4-th edition. — Elsevier E-Book, 2020. — 2526 p.
- Гриппи М. А. Патофизиология лёгких. — 2-е издание, исправленное. — М.: Бином, 2022. — 304 с.
- Morton S. U., Brodsky D. Fetal Physiology and the Transition to Extrauterine Life // Clin Perinatol. — 2016. — № 3. — Р. 395–407. ссылка
- Praagh R. V. Congenital Heart Disease: A Clinical, Pathological, Embryological, And Segmental Analysis. — Elsevier, OHCE, 2022. — Р. 767–817.
- Кривощеков Е. В., Ковалева И. А., Шипулина В. М. Врождённые пороки сердца: справочник для врачей. — Томск: STT, 2009. — 286 с.
- Kidd L., Driscoll D. J., Gersony W. M. et al. Second natural history study of congenital heart defects. Results of treatment of patients with ventricular septal defects // Circulation. — 1993. — Vol. 87. — P. I38–51. ссылка
- Jonas R. A. Comprehensive Surgical Management of Congenital Heart Disease, Second Edition. — CRC Press, 2014. — P. 331–346.
- Bronzetti G. Atlas of Pediatric and Youth ECG. — Springer International Publishing, 2018. — 320 p.
- Lai W. W., Mertens L. L., Cohen M. S., Geva T. Echocardiography in Pediatric and Congenital Heart Disease, From Fetus to Adult. — 2nd edition. — Jonh Wiley & Sons Ltd, 2016. — P. 215–230.
- Kirklin j. K., Blackstone E. H. Kirklin/Barratt-Boyes Cardiac Surgery. — 4th edition. — Elsevier Saunders, 2013. — P. 446–459, 1275–1319.
- Artemiou P., Gasparovic I., Hudec V., Hulman M. Optimal therapeutic strategy for postinfarction ventricular septal defect // J Card Surg. — 2022. — № 8. — Р. 2511. ссылка
- Хапаев С. А. Хирургическое лечение осложнений инфаркта миокарда левого желудочка и межжелудочковой перегородки: автореф. дис. … д-ра мед. наук: 14.00.44, 14.00.06. — Новосибирск, 2005. — 40 с.
- Beerman L. B. Eisenmenger Syndrome // MSD Manual. — 2023.
- Shaddy R. E., Penny D. J., Feltes T. F. et al. Moss & Adams’ Heart Disease in Infants, Children and Adolescents Including the Fetus and Young Adult, Volume I–II. — 10th edition. — Wolters Kluwer, 2022. — P. 2313–2317.
- Hoffman J. I. E. Congenital Heart Disease: Incidence and Inheritance. Congenital Heart Disease: Incidence and Inheritance // Pediatric Clinics of North America. — 1990. — № 1. — Р. 25–43.ссылка
- Jonas R. A. Comprehensive Surgical Management of Congenital Heart Disease. — 2nd edition. — CRC Press, 2014. — 333 р.
- Armstrong G. P. Infective Endocarditis // MSD Manual. — 2022.
- Park I. S. An Illustrated Guide to Congenital Heart Disease. — Springer Nature Singapore Pte Ltd., 2019. — P. 34, 50.
- Structural Interventions: Congenital Heart Defects // Abbott. [Электронный ресурс]. Дата обращения: 13.10.2023.