Псевдомембранозный колит (Pseudomembranous colitis) — это острое воспалительное заболевание толстого кишечника, вызываемое токсигенными штаммами бактерии Clostridium difficile . Микроб вырабатывает токсины А и В, повреждающие кишечную стенку, и белок, угнетающий перистальтику кишечника. В результате возникает диарея, боль в животе, появляется слизь и иногда примесь крови в кале.
Характерным признаком заболевания являются фиброзные наложения на слизистой оболочке толстой кишки .
Псевдомембранозный колит
Псевдомембранозный колит (ПМК) чаще всего развивается после лечения антибиотиками. Его ещё называют Clostridium difficile-ассоциированным псевдомембранозным колитом, антибиотик-ассоциированным псевдомембранозным и клостридиозным колитом.
Эпидемиология
Заболеваемость ПМК лучше всего отслеживается в США и странах западной Европы . В России статистический учёт заражения C. diff не ведётся. Согласно систематическому обзору за 2011 год, каждый 5-й случай из всех антибиотик-ассоциированных диарей (ААД) и каждый 2–3 случай внутрибольничной ААД в странах Европы и Северной Америки вызваны C. diff .
В стационарах США среди внутрибольничных инфекций C. diff занимает первое место (12,1 % от общего количества), опережая K. pneumoniae (9, 7 %) и E. coli (9,3 %) . В 2011 г. было зафиксировано более 450 тыс. случаев C. difficile-ассоциированной болезни и более 29 тыс. смертей от неё .
В европейских странах заболеваемость C. diff составляет около 7 случаев на 10000 койко-дней, т. е. при средней госпитализации 10 дней, 7 случаев из 1000 госпитализаций заканчиваются ПМК. В 20 европейских странах это значение колеблется от 0,7 до 28,7 на 10000 койко-дней .
В России в 2011 году было продано 295 млн упаковок антибиотиков, в 2019 — 379 млн . Антибактериальных препаратов потребляется всё больше, их продажа из аптек не контролируется, поэтому проблемы ААД и ПМК актуальны и в нашей стране.
В клиниках Санкт-Петербурга у пациентов с ААД тест на токсины C. diff был положительным в 47,7 % случаев .
Смертность от ПМК колеблется от 9,3 до 22 % и зависит от возраста пациента, смерть чаще наступает при тяжёлом течении заболевания .
В настоящее время увеличилась внутри- и внебольничная заболеваемость C. difficile-ассоциированной болезнью, расширились группы риска, стали чаще встречаться рецидивы и тяжёлые формы, в том числе вызванные более патогенным штаммом BI/NAP1/027, возросла смертность .
Причины псевдомембранозного колита
Основная причина болезни — это приём антибиотиков. ПМК могут вызывать любые антибактериальные препараты, но наиболее часто к нему приводит применение Клиндамицина, хинолонов, цефалоспоринов 2-го и 3-го поколения, карбапенемов. Реже ПМК развивается после приёма макролидов, пенициллина, Тетрациклина, Тигециклина.
К факторам риска, помимо приёма антибиотиков, относятся:
- возраст старше 65 лет;
- терапия ингибиторами протонной помпы и Н2-гистаминоблокаторами — препаратами, снижающими секрецию соляной кислоты в желудке;
- лечение в стационаре, особенно в отделениях реанимации, — каждые 7 дней госпитализации увеличивают риск ПМК на 8 % ;
- наличие дополнительной патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, сахарного диабета ;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- приём иммуносупрессивных препаратов (глюкокортикостероидов, Такролимуса) и противоопухолевых средств .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы псевдомембранозного колита
Наиболее частые симптомы лёгкого или умеренного псевдомембранозного колита:
- водянистая диарея (жидкие испражнения, похожие на кашицу) от трёх раз в сутки на протяжении двух и более дней в сочетании с болью в животе;
- лёгкие спазмы в животе, часто сопровождающиеся с позывами на стул, но не всегда приводящие к дефекации;
- примеси слизи, крови или гноя в испражнениях;
- температура тела 38,5 °С и более;
- тошнота или потеря аппетита.
При тяжёлом течении псевдомембранозного колита возникает водянистая диарея с кровью, уровень альбумина снижается менее 30 г/л, что сочетается с одним из следующих симптомов: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10/л) и/или болезненностью при ощупывании живота. На фоне длительной диареи организм теряет много жидкости, что приводит к обезвоживанию и проявляется тёмно-жёлтой мочой, чувством жажды, усталости, головокружением, спутанностью сознания и заторможенностью .
При рецидиве болезни симптомы появляются повторно менее чем через 8 недель после окончания терапии.
Проявления псевдомембранозного колита схожи с симптомами других инфекций, поражающих толстый кишечник. Но в отличие от них признаки ПМК могут быть слабо выражены и, как правило, наблюдаются долго: от одной недели до нескольких месяцев. Также встречаются случаи, когда человек является носителем возбудителя ПМК — C. diff, но симптомы полностью отсутствуют.
Патогенез псевдомембранозного колита
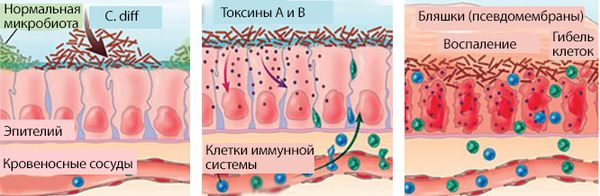
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента .
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины . Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.
Патогенез ПМК
Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
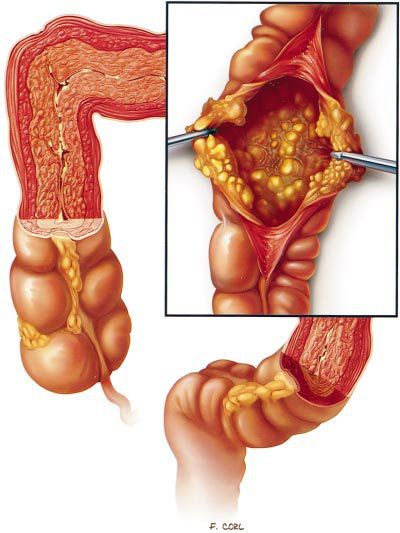
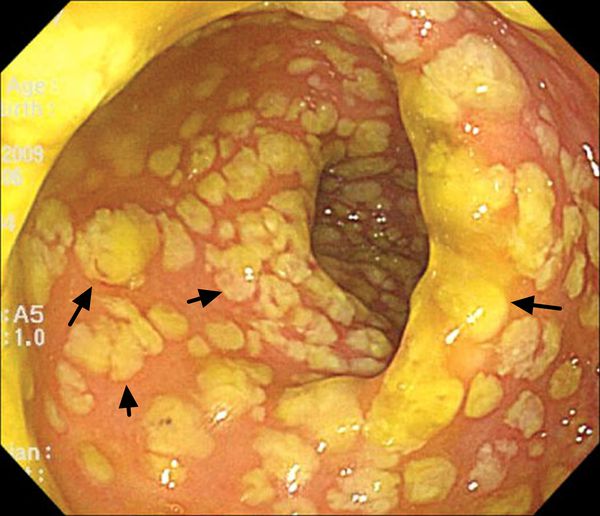
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
Бляшки при ПМК [35]
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия .
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
Классификация и стадии развития псевдомембранозного колита
ПМК входит в группу антибиотик-ассоциированных диарей. В Международной классификации болезней (МКБ-10) псевдомембранозный колит кодируется как АО 4.7 — Энтероколит, вызванный Clostridium difficile.
В зависимости от тяжести течения болезни и клинической картины выделяют следующие формы:
- ПМК лёгкой или умеренной тяжести. Проявляется диареей — неоформленным жидким, кашицеобразным стулом три или более раз в сутки и болью в животе.
- ПМК тяжёлого течения. Сопровождается водянистой диареей с кровью и изменениями в анализах. В биохимическом анализе крови отмечается низкий уровень альбумина (меньше 30 г/л), который сочетается с одним из следующих признаков: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10/л) в клиническом анализе крови и/или болезненностью при ощупывании живота.
- Осложнённые формы ПМК. Протекают с водянистой диареей с кровью и одним из следующих симптомов: снижение артериального давления, температура тела ≥ 38,5 °C, отсутствие перистальтики тонкого кишечника, помрачение или угнетение сознания. В клиническом анализе крови лейкоциты повышены > 25×10/л или снижены < 2×10/л, возникает органная и почечная недостаточность, требуется искусственная вентиляция лёгких.
- Рецидивирующее течение ПМК. Заболевание развивается повторно менее чем через 8 недель после окончания терапии .
Данная классификация используется для выбора схемы лечения.
Осложнения псевдомембранозного колита
Наиболее частые осложнения псевдомембранозного колита:
- Обезвоживание и электролитные нарушения — из-за сильной и длительной диареи нарушается ритм сердца, снижается артериальное давление и мышечный тонус. Чаще эти осложнения развиваются при недостаточном восполнении потерянной жидкости и солей.
- Почечная недостаточность — при стремительном обезвоживании нарушается работа почек, из-за чего снижается частота мочеиспусканий, появляются отёки, по анализам крови видно, что растёт содержание азотистых шлаков.
- Токсический мегаколон — расширение толстой кишки, редкое осложнение с плохим прогнозом. На фоне диареи частота стула резко урежается до одного раза в сутки, в дальнейшем дефекация прекращается полностью. Это происходит из-за замедления и полного прекращения перистальтики толстого кишечника. Из-за распирания толстого кишечника газами и содержимым нарастает вздутие живота, усиливается боль в нём. Интоксикация и электролитные нарушения приводят к резкому ухудшению самочувствия и выраженной слабости. В дальнейшем стенка кишки разрывается, содержимое изливается в брюшную полость (перфорация кишечника) и начинается перитонит. Как правило, это осложнение наблюдается у ослабленных пациентов, находящихся в отделении реанимации и хирургии.
- Перфорация кишечной стенки — образуется сквозное отверстие в кишечной стенке с излитием содержимого кишечника в брюшную полость и развитием перитонита.
- Полиорганная недостаточность — может привести к гибели пациента .
Диагностика псевдомембранозного колита
Тесты на C. diff показаны при длительной диарее с болью в животе и/или примесью крови в стуле, возникшей спустя 3–60 суток после выписки из стационара и/или после приёма антибиотиков .
Чтобы выявить токсигенные штаммы C. diff, токсины A и B определяют в кале .
Для этого используют следующие методы:
- Цитотоксиновый копрологический тест. Чувствительность — 95 %, специфичность — 99 %, результат — в течение 2–3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay) — фермент-связанный иммуносорбентный тест для определения токсинов. Чувствительность — 70–90 %, специфичность — 99 %, результат — через 4–6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В. Чувствительность — 96 %, специфичность — 100 %, результат — в течение нескольких часов.
Чувствительность теста — это доля положительных результатов среди больных людей, т. е. вероятность правильно определить инфекцию у заболевших, отсутствие ложноотрицательных результатов. Специфичность — доля отрицательных результатов среди здоровых людей, т. е. отсутствие ложноположительных результатов.
Посев кала на C.diff не проводится, так как этим методом не удаётся определить токсигенные штаммы.
С помощью дополнительных методов можно оценить тяжесть состояния пациента и своевременно выявить осложнения.
К дополнительным обследованиям относятся:
- ректороманоскопия или сигмоидоскопия — позволяют обнаружить типичные изменения стенки кишки (множественные желтоватые бляшки 2–10 мм в диаметре, плотно фиксированные на поверхности слизистой оболочки);
Ректороманоскопия
- колоноскопия — помимо типичных изменений кишечной стенки, определяется распространённость процесса и поражение толстого кишечника выше сигмовидной кишки ;
- обзорная рентгенография органов брюшной полости — используется, чтобы выявить признаки пареза кишечника и токсического расширения кишки;
- анализ крови — показывает уровень лейкоцитов (при ПМК повышен до 10–50×10), уровень креатинина (выше нормы) и альбумина (ниже нормы).
Гистологическое исследование биоптатов не является необходимым при C. difficile-ассоциированной болезни, но может быть крайне важным для дифференциальной диагностики.
Лечение псевдомембранозного колита
Методы лечения псевдомембранозного колита в российских и зарубежных клинических рекомендациях совпадают . При лёгком и среднетяжёлом течении его проводят в амбулаторных условиях (дома), при тяжёлом и/или осложнённом — в стационаре.
Для лечения ПМК назначаются антибиотики:
- Терапия первой линии — Метронидазол . Препарат хорошо всасывается при приёме внутрь, применяется в течение 10 дней.
- Терапия второй линии — Ванкомицин. Применяется, если не эффективен Метронидазол и/или при тяжёлом течении заболевания. Плохо всасывается в кишечнике при приёме внутрь и оказывает преимущественно местное действие . Курс также составляет 10 дней.
- Терапия резерва — Фидаксомицин, бактерицидный антибиотик группы макролидов местного действия, в России не зарегистрирован .
- При осложнённом течении применяется комбинация Ванкомицин + Метронидазол. Лечение проводится в стационаре.
Антибиотики подавляют развитие C. diff. Бактерия чувствительна только к трём перечисленным антибактериальным препаратам.
При развитии осложнений ПМК могут применяться следующие методы:
- При токсическом мегаколоне показана колэктомия — удаление толстой кишки.
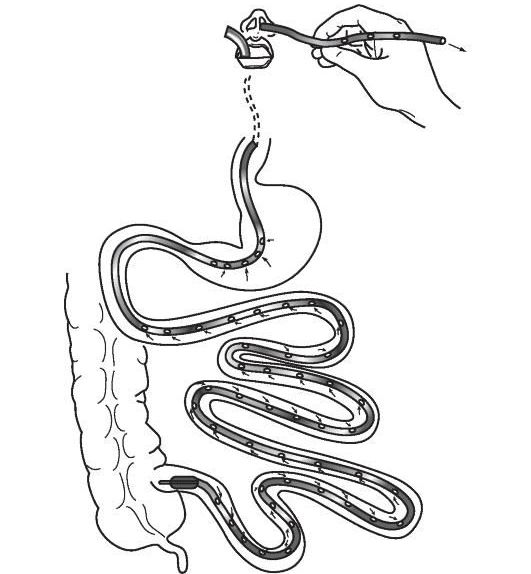
- Для лечения рецидивирующего ПМК в качестве экспериментального метода рассматривается трансплантация кишечной микробиоты (fecal microbiota transplantation, FMT) . Кишечную микробиоту берут от здорового донора и при помощи назоинтестинального зонда, клизмы или колоноскопии переносят пациенту в кишечник. В России такое лечение считается экспериментальным. Проводится в научных клинических учреждениях, например в Федеральном научно-клиническом центре ФМБА России.
Назоинтестинальный зонд
В качестве вспомогательных и симптоматических препаратов используются:
- Сорбенты (Диоктаэдрический смектит) — эффективно удаляет токсины C. diff, снижая их действие на кишечную стенку, улучшает качество стула.
- Пробиотики (Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium infantis не менее 1×10 КОЕ/г) — подавляют активность C. diff. Данные об их эффективности пока противоречивы .
- Препараты на основе дрожжей Saccharomyces cerevisiae (boulardii) — эффективны как вспомогательные и профилактические средства.
Прогноз. Профилактика
При лёгком или среднетяжёлом течении ПМК и хорошей реакции на стандартную терапию прогноз благоприятный, при тяжёлом и осложнённом — неблагоприятный. При рецидивирующем течении прогноз сомнительный, так как не разработаны эффективные схемы лечения.
Профилактика псевдомембранозного колита
Для профилактики развития ПМК следует:
- чаще мыть руки и соблюдать правила личной гигиены;
- рационально принимать антибиотики — строго по назначению врача с соблюдением всех указаний;
- изолировать пациентов с инфекцией C. diff в отдельные палаты, соблюдать меры санитарного режима;
- тщательно обрабатывать все поверхности хлорсодержащими или другими дезинфицирующими средствами, активными против спор C. diff;
- сокращать сроки госпитализации пациентов старше 65 лет .
Чтобы предотвратить рецидив C. difficile-ассоциированной болезни, после завершения лечения Метронидазолом или Ванкомицином назначаются пробиотики курсом не менее трёх месяцев. Серьёзных побочных эффектов от них не выявлено .
Список литературы
- Ивашкин В. Т., Ющук Н. Д., Маев И. В. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению Clostridium difficile-ассоциированной болезни // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2016. — № 5. — С. 56–65.
- Goudarzi M., Seyedjavadi S. S., Goudarzi H. et al. Clostridium difficile Infection: Epidemiology, Pathogenesis, Risk Factors, and Therapeutic Options // Scientifica (Cairo). — 2014.ссылка
- Nelson R. L., Kelsey P., Leeman H. et al. Antibiotic treatment for Clostridium difficile-associated diarrhea in adults // Cochrane Database Syst Rev. — 2011. — № 9.ссылка
- Magill S. S., Edwards J. R., Bamberg W. et al. Multistate Point-Prevalence Survey of Health Care–Associated Infections // N Engl J Med. — 2014. — № 13. — Р. 1198–1208. ссылка
- Davies K. A., Longshaw C. M., Davis G. L. et al. Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, point-prevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID) // Lancet Infect Dis. — 2014. — № 12. — Р. 1208–1219. ссылка
- Захарова Н. В., Филь Т. С. Микробиологические и клинические особенности инфекции Clostridium difficile // Инфекционные болезни. — 2015. — № 3. — С. 81–86.
- Lessa F. C., Winston L. G., McDonald L. C. et al. Emerging Infections Program C. difficile Surveillance Team. Burden of Clostridium difficile infection in the United States // N Engl J Med. — 2015. — № 24. — Р. 2369–2370. ссылка
- Анализ рынка антибиотиков в России в 2007–2011 гг, прогноз на 2012–2016 гг // BusinesStat. — 2012. — 82 c.
- Centers for Disease Control and Prevention. What is C. diff? — 2021. ссылка
- Hensgens M. P., Goorhuis A., Dekkers O. M. et al. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics // J Antimicrob Chemother. — 2012. — № 3. — Р. 742–748. ссылка
- Centers for Disease Control and Prevention. Vital Signs: Preventing Clostridium difficile Infections // Morbidity and Mortality Weekly Report (MMWR). — 2012. — № 9. — Р. 157–162. ссылка
- Surawicz C. M., Brandt L. J., Binion D. G. et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections // Am J Gastroenterol. — 2013. — № 4. — Р. 478–498.ссылка
- Сотников В. Н., Разживина А. А., Веселов В. В. и др. Колоноскопия в диагностике заболеваний толстой кишки. — М: Экстрапринт, 2006. — 272 с.
- Шептулин А. А. Рефрактерные и рецидивирующие формы колита, ассоциированного с Clostridium difficile // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2011. — № 2. — С. 50–53.
- Mayo Clinic. Pseudomembranous colitis. — 2020.
- Planche T., Aghaizu A., Holliman R. Diagnosis of Clostridium difficile infection by toxin detection kits: a systematic review // Lancet Infect Dis. — 2008. — № 12. — Р. 777–784. ссылка
- Cerilli L. A., Greenson J. K. The differential diagnosis of colitis in endoscopic biopsy specimens: a review article // Arch Pathol Lab Med. — 2012. — № 8. — Р. 854–864.ссылка
- Рациональная фармакотерапия заболеваний органов пищеварения / под ред. В. Т. Ивашкина. — М.: Литтерра, 2011. — С. 522–526.
- Министерство здравоохранения РФ. Метронидазол: инструкция к по медицинскому применению лекарственного препарата. — 2021. — 9 с.
- Министерство здравоохранения РФ. Ванкомицин: инструкция к по медицинскому применению лекарственного препарата. — 2020. — 16 с.
- Fidaxomicin // Drugs in R&D. — 2010. — № 1. — Р. 37–45.ссылка
- Johnston B. C., Ma S. S., Goldenberg J. Z. et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea: a systematic review and meta-analysis // Ann Intern Med. — 2012. — № 12. — Р. 878–888. ссылка
- Silverman M. S., Davis I., Pillai D. R. Success of self-administered home fecal transplantation for chronic Clostridium difficile infection // Clin Gastroenterol Hepatol. — 2010. — № 5. — Р. 471–473.ссылка
- Kleger A., Schnell J., Essig A. et al. Fecal transplant in refractory Clostridium difficile colitis // Dtsch Arztebl Int. — 2013. — № 7. — Р. 108–115.ссылка
- Шрайнер Е. В., Курилович С. А., Осипенко М. Ф. Трансплантация кишечной микробиоты: терапевтический потенциал при болезнях органов пищеварения // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2014. — № 5. — С. 63–68.
- Нечаева Ю. Обзор продаж антибактериальных препаратов по итогам 9 месяцев 2020 года // Ремедиум. — 2020. — № 10. — С. 18–21.
- Ивашкин В. Т., Шифрин О. С., Тертычный А. С. Clostridium difficile-ассоциированная болезнь // Росcийский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2015. — № 6. — С. 5–17.
- Шептулин А. А. Рефрактерные и рецидивирующие формы колита, ассоциированного с Clostridium difficile // Росcийский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2011. — № 2. — С. 50–53.
- Lessa F. C., Mu Y., Bamberg W. M. et al. Burden of Clostridium difficile infection in the united states // N Engl J Med. — 2015. — № 9. — Р. 825–834.ссылка
- Vecchio A. L., Zacur G. M. Clostridium difficile infection: an update on epidemiology, risk factors, and therapeutic options // Curr Opin Gastroenterol. — 2012. — № 1. — Р. 1–9. ссылка
- Furuya-Kanamori L., Stone J. C., Clark J. et al. Comorbidities, exposure to medications, and the risk of community-acquired Clostridium difficile infection: A systematic review and meta-analysis // Infect Control Hosp Epidemiol. — 2015. — № 2. — Р. 132–141. ссылка
- Haines C. F., Moore R. D., Bartlett J. G. et al. Clostridium difficile in a HIV-infected cohort: incidence, risk factors, and clinical outcomes // AIDS2013. — № 17. — Р. 2799–2807. ссылка
- Rodemann J. F., Dubberke E. R., Reske K. A. et al. Incidence of Clostridium difficile infection in inflammatory bowel disease // Clin Gastroenterol Hepatol. — 2007. — № 3. — Р. 339–344.ссылка
- Hempel S., Newberry S. J., Maher A. R. et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis //JAMA. — 2012. — № 18. — Р. 1959–1969.ссылка
- Yu J. H., Kim N. Y., Lee H. M. et al. A case of pseudomembranous colitis in a juvenile rheumatoid arthritis patient taking methotrexate // Korean J Gastroenterol. — 2010. — № 6. — Р. 387–390. ссылка