Болезнь Гентингтона (хорея Гентингтона) — это хроническое, неуклонно прогрессирующее, наследственное аутосомно-доминантное заболевание нервной системы. Болезнь проявляется нарушением речи, памяти и присутствием навязчивых вычурных движений, мешающих выполнять повседневную деятельность. Со временем пациент теряет навыки самообслуживания и нуждается в опеке, то есть инвалидизируется.
Термин «хорея» означает «танец» на греческом языке. Впервые это определение использовал известный алхимик Парацельс при описании «пляски святого Витта». Эта «пляска», возможно, была связана с религиозным экстазом, то есть имела истерический характер .

Пляска святого Витта
Позже английский врач Томас Сиденгам в процессе изучения «пляски святого Витта» описал детскую форму хореи, теперь это заболевание носит его имя. В 1872 году американский врач Джордж Гентингтон отметил наследственный вариант хореи с началом во взрослом возрасте. Впоследствии это заболевание получило название «болезнь Гентингтона» (БГ). Также его называют хореей Гентингтона (или Хантингтона), наследственной или дегенеративной хореей.
Классическим описанием патологии считается эссе «О хорее», опубликованное Джорджем Гентингтоном в «Медицинском и хирургическом вестнике» . В настоящее время хорея Гентингтона является самой частой причиной наследственной хореи. Одним из самых известных людей, страдавших этим заболеванием, был американский кантри певец и композитор Вуди Гатри, который заболел в 50-е годы.

Певец и композитор Вуди Гатри
Болезнь может начинаться в разном возрасте, но чаще всего симптомы появляются в 30-50 лет и неуклонно прогрессируют . Описаны две основные клинические формы болезни Гентингтона:
- гиперкинетическая, наиболее частая, характеризуется более поздним началом, постепенным прогрессированием хореических гиперкинезов (насильственных избыточных двигательных актов, возникающих помимо воли больного), а также деменцией с замедлением когнитивных функций, снижением критики, депрессией, разнообразными психозами;
- акинетико-ригидная с началом в раннем возрасте (вариант Вестфаля) наблюдается в 5-10 % случаев, характеризуется быстрым нарастанием мышечной слабости, контрактур (ограничением подвижности суставов), нарушениями поведения и психики, эпилепсией, наблюдается при передаче мутантного гена от отца.
Нейроморфологическая картина характеризуется уменьшением, то есть атрофией, полосатого тела (стриатума — глубинной структурной части мозга) уже на самой ранней стадии заболевания. На более развёрнутой стадии возможна атрофия коры головного мозга.
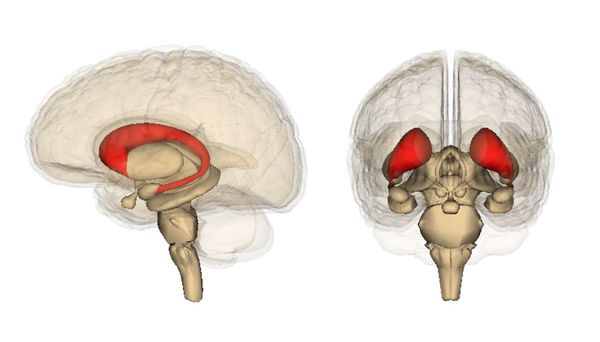
Полосатое тело (стриатум)
Распространённость хореи в Западной Европе составляет в среднем 4-10 случаев на 100 000 населения, поэтому патологию можно отнести к редким заболеваниям . Наименьшая частота хореи Гентингтона установлена среди жителей Японии, Финляндии, Южной Африки и Северной Америки (7,33 на 100 000 населения). Самая высокая частота (более 17 случаев на 100 000 населения) зафиксирована в районе озера Маракайбо в Венесуэле, в Тасмании и на островах Маврикий . В Российской Федерации распространённость патологии в целом не оценивалась, цифры по различным регионам разнятся.
Мужчины и женщины болеют одинаково часто, однако существует механизм так называемой «отцовской передачи» заболевания, при котором наиболее тяжёлые варианты болезни наследуются от отца, особенно в случае передачи мутантного гена на протяжении нескольких поколений. Это объясняется нестабильностью региона, содержащего мутацию, и нарастанием числа повторов в процессе сперматогенеза .
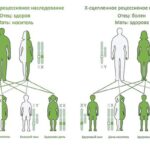
Причина заболевания — мутация в гене HTT, который отвечает за образование белка гентингтина. Гены — самые маленькие единицы наследственности, которые содержатся в хромосомах. В соматических клетках человека всего одна пара половых хромосом и 22 пары аутосом. Болезнь Гентингтона явлется аутосомно-доминантным заболеванием, то есть мутантный ген расположен в аутосоме и является преобладающим. Это значит, что для развития болезни достаточно унаследовать мутантный ген от одного из родителей.
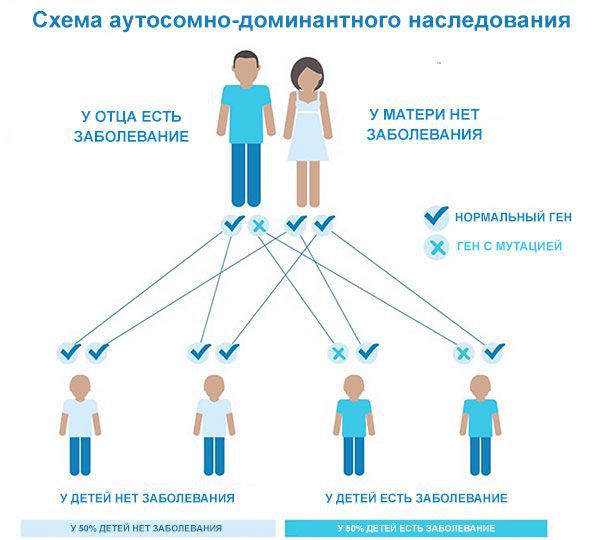
Аутосомно-доминантный тип наследования
Предрасполагающими факторами развития болезни могут стать психотравмы, черепно-мозговые травмы или перенесённые инфекции.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы хореи Гентингтона
При болезни Гентингтона присутствует многолетняя стадия «предболезни», которая определяется постепенным нарастанием субклинических и биохимических изменений в структурах головного мозга. В самом начале появляются двигательные нарушения: насильственные избыточные двигательные акты, возникающие помимо воли больного — хореический гиперкинез. С развитием болезни присоединяются когнитивные или психические расстройства.
Прогрессирование заболевания в некоторых случаях может сопровождаться постепенным уменьшением выраженности непроизвольных движений, но усилением психических симптомов . Однако для каждой из форм болезни выделяют превалирующие симптомы.
Клинические проявления можно распределить по следующим группам :
1. Двигательные нарушения могут проявляться общим двигательным беспокойством в движениях рук и ног, возникающим при стрессе, волнении или ходьбе. Патогномоничным (характерным) и самым ранним двигательным симптомом являются глазодвигательные нарушения. По мере прогрессирования заболевания появляются грубые нарушения следящих движений глазных яблок, следовательно, пациент практически не может зафиксировать взгляд на каком-либо предмете. Постепенно к хорее присоединяются иные нарушения, например дистония (стабильные рефлекторные двигательные сокращения отдельных групп мышц) и паркинсонизм (снижение скорости движения, скованность мышц и дрожание конечностей).
Одним из основных двигательных нарушений является отсутствие контроля произвольных движений. Пациент не может удерживать какую-либо позу по причине грубых насильственных двигательных актов. На более поздних стадиях больным сложно выполнять движения, которые требуют тонкой координации. Значительно замедляется двигательная активность и нарушается ходьба, в результате человек часто падает. Больные широко расставляют ноги при ходьбе, корпус тела и шея вытянуты вперёд, корпус тела несколько повёрнут вокруг своей оси. При ходьбе появляется как бы пританцовывание, если пациент не пользуется компенсаторными приёмами, чтобы уменьшить насильственное движение (например, если не держится одной рукой за другую). Также повышается вероятность возникновения тонического напряжения мышц, приводящих бёдра. В таком случае больные передвигаются со сведёнными бёдрами и коленями.
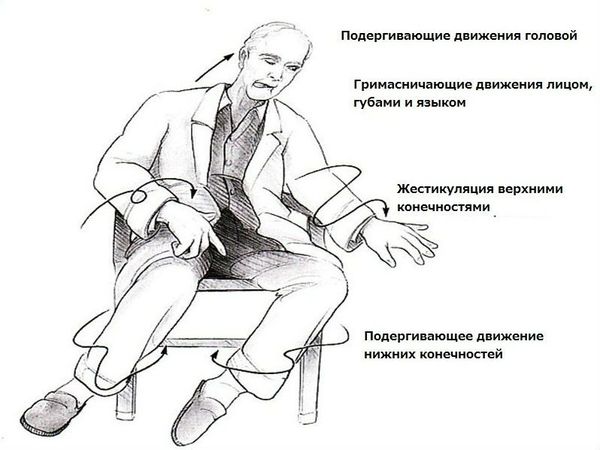
Хореические гиперкинезы
Виды гиперкинезов:
- Хорея — проявляется неритмичным, отрывистым, кажущимся произвольным движением.
- Атетоз — это гиперкинез, который проявляется замедленным и червеобразным движением.
- Баллизм — это резкие, размашистые движения рукой или ногой.
- Дистония характеризуется медленным и неритмичным мышечным сокращением, которое часто приводит к формированию патологической позы.
- Миоклонус — это внезапные, быстрые и отрывистые движения, напоминающее удар электрического тока.
Другие двигательные проявления:
- Брадикинезия (медлительность).
- Мышечная ригидность (скованность).
- Окуломоторные (глазодвигательные) расстройства.
- Падения.
2. Когнитивные нарушения. Трудности в общении, организации собственной деятельности, упорядочивании своих мыслей и в усвоении новой информации, а также нарушения восприятия, повышенная отвлекаемость, нарушения памяти и умственной работоспособности могут появляться уже на ранних этапах заболевания. Это практически универсальные проявления хореи Гентингтона. Максимально страдают исполнительные функции, то есть способность планировать свои действия, а также оценивать агрессивное поведение. У большинства пациентов отмечается замедление психомоторных процессов, появляется апатия, снижение внимания к себе.
3. Психические нарушения: депрессия, тревога, апатия, обсессивно-компульсивные расстройства (навязчивые и бредовые идеи), раздражительность, психотические расстройства (агрессия, галлюцинации и др.), гиперсексуальность. Психические нарушения при болезни Гентингтона характеризуются в первую очередь депрессией и тревогой. Нередко можно отметить раздражительность, которая иногда становится причиной агрессивного поведения. Появление обсессивно-компульсивных расстройств значимо ухудшает качество жизни родственников, проживающих вместе с больным. Значительно реже у пациентов могут появляться психозы. Реализованные суициды и суицидальные попытки встречаются при болезни Гентингтона в 4 раза чаще, чем в общей популяции, и в 5 % случаев становятся причиной гибели при этом заболевании .
4. Метаболические расстройства: потеря массы тела, вплоть до кахексии (истощения) и др.
5. Прочие нарушения: расстройства сна, дизартрия (нарушение речи, при котором трудно произносить некоторые слова) и дисфагия (расстройство акта глотания). Больной испытывает трудности при разговоре, речь становится медленной, голос тихим и глухим, речь прерывается сопением, всхрапыванием, всхлипыванием, при осмотре выявляются элементы дизартрии. Тем не менее, даже на поздних стадиях пациенты доступны контакту. Из-за гиперкинезов языка, мягкого нёба, губ, диафрагмы и прямых мышц живота непроизвольные, «лишние» звуки (икота, сопение и др.) могут возникать даже когда больной молчит.
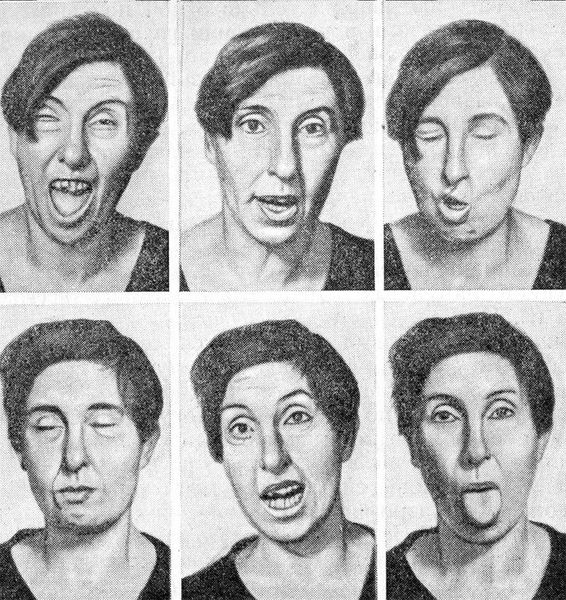
Гиперкинезы языка, мягкого нёба, губ
Патогенез хореи Гентингтона
Морфофункциональные изменения в мозге возникают намного раньше, чем появляются первые симптомы болезни Гентингтона . Морфологические изменения в первую очередь касаются области полосатого тела. Характерным признаком при нейровизуализации является атрофия головки хвостатого ядра. В процесс вовлекаются: чёрная субстанция, кора больших полушарий, гиппокамп и мозжечок. Чуть в меньшей степени — боковые ядра гипоталамуса и таламус .
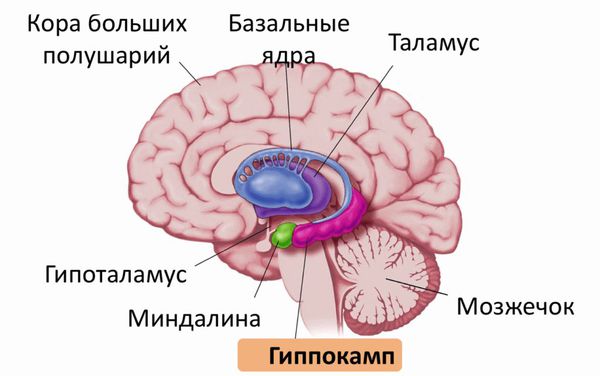
Строение головного мозга
Патофизиологические механизмы развития болезни Гентингтона до конца не изучены. Большое значение в патогенезе этого заболевания имеет накопление и токсическое действие на нейроны мутантного белка гентингтина, в состав которого входит аминокислота глутамин.
За образование белка гентингтина отвечает ген HTT, который расположен в коротком плече 4-й хромосомы человека. При отсутствии патологии в этом участке находится определённое количество повторов последовательности тринуклеотидов цитозин-аденин-гуанин (ЦАГ) — от 6 до 35. Мутация заключается в увеличении числа повторов ЦАГ (более 40), в результате чего мутантный белок гентингтин за счёт избыточного содержания остатков аминокислоты глутамина становится токсичным в отношении определённых видов нейронов .
Число повторов ЦАГ:
- До 26 — норма.
- От 27 до 35 (нестабильное количество) — симптомы отсутствуют, но есть повышенный риск того, что у детей будет болезнь Гентингтона.
- 36 или больше — патогенные мутации с различной пенетрантностью (проявление гена у 100 % лиц с соответствующим генотипом называется полной пенетрантностью, в остальных случаях — неполной пенетрантностью): 36-39 — «зона неполной пенетрантности»; более 40 — полная пенетрантность.
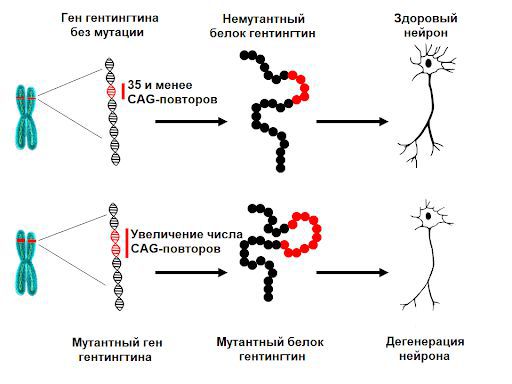
Норма и мутация гена
«Неправильный» белок повреждает нервные клетки головного мозга при встраивании в процесс обмена веществ. Поэтому возникают симптомы, характерные для болезни Гентингтона. Удлинённый участок молекулы белка гентингтина способствует формированию патологических межмолекулярных связей. Таким образом, болезнь Гентингтона является «полиглутаминовым заболеванием» . Одним из новых патогенетических механизмов развития патологии, особенно в ранней стадии дегенеративного процесса, является нейровоспаление, активируемое мутантным гентингтином в центральной нервной системе через моноциты и микроглиальные клетки .
К особенностям наследования БГ относятся:
- Антиципация — феномен, при котором увеличение ЦАГ-повторов нарастает в ряду поколений, что означает более раннее возникновение болезни и более тяжёлое течение по сравнению с предыдущими поколениями.
- Феномен «отцовской передачи». Более тяжёлая форма заболевания развивается, если патология передалась от отца, симптомы появляются в детском возрасте.
- Наличие «зоны неполной пенетрантности», или «серой зоны» (у части лиц с такими мутациями болезнь развивается, а у других заболевание может отсутствовать даже в преклонном возрасте) .
- Эффект геномного импринтинга. При наследовании болезни Гентингтона гены отца и матери активированы или супрессированы по‐разному.
Интересно, что генетическая нестабильность мутации при болезни Гентингтона реализуется преимущественно у лиц мужского пола (процесс образования половых клеток), и эти наблюдения объясняют эффект «отцовской передачи» — манифестацию более ранних и тяжёлых случаев болезни гентингтона у потомков больного отца .
Классификация и стадии развития хореи Гентингтона
Для болезни Гентингтона, как и для других нейродегенеративных заболеваний, установлено существование длительной, многолетней стадии “предболезни”. В этот период действие мутантного гена ещё не успело привести к диагностируемой клинической картине, но патохимические нарушения в нейронах уже накапливаются, и возникает ряд субклинических проявлений .
Этапы жизни пациента с болезнью Гентингтона (классификация профессора неврологии Раймунда Рооса) :
Доклиническая стадия (как правило, длится 10-15 лет до появления первых симптомов):
- Асимптомный период. У носителя мутации заболевания не отмечается субъективных, клинических или измеряемых инструментально изменений.
- Продромальный период (период предвестников заболевания) характеризуется постепенным появлением и нарастанием невыраженных двигательных, когнитивных и поведенческих изменений. Однако такие изменения не позволяют поставить клинический диагноз болезни Гентингтона
Клиническая стадия (средняя продолжительность заболевания — 15-18 лет ):
- Клиническая стадия I. Появляются первые неврологические, когнитивные или психические симптомы. Основной симптом — беспорядочные, отрывистые, нерегулярные, кажущиеся произвольными движения. В повседневной жизни пациенту не требуется помощь. Летальный исход в этот период случается редко, за исключением случаев суицида.
- Клиническая стадия II. Нарастают двигательные нарушения, пациенту требуется помощь в самообслуживании. Смерть возможна в результате суицида.
- Клиническая стадия III. Тяжёлые двигательные нарушения, больной не способен на самообслуживание, полностью зависит от окружающих. Летальный исход наступает в результате осложнений заболевания.
На основании преобладания какого-либо синдрома различают несколько форм болезни Гентингтона:
1. «Классическая» гиперкинетическая форма. Характеризуется наличием навязчивых движений, нарушением походки (”танцующая походка”) и речи, а также снижением мыслительной деятельности.
2. Ригидная форма:
- Ювенильная (вариант Вестфаля). В отличие от классического варианта болезни, при ювенильной форме дебют происходит в возрасте до 21 года и наблюдается более тяжёлое течение и характер неврологической симптоматики. Проявления хореи минимальны, преобладают акинезия (отсутствие движения) и ригидность (болезненное состояние, при котором повышен тонус мышц и возникает сопротивление при попытке сделать движение). Кроме того, неврологические проявления при ювенильной форме более разнообразны: для неё характерны эпилепсия, атаксия (расстройство координации), миоклонии (молниеносные подёргивания отдельных групп мышц), дистония и другие расстройства, нетипичные для классической БГ. Давно известны генеалогические особенности этой формы: она развивается преимущественно при наследовании болезни от отца .
- Поздняя форма. Нередко является следствием прогрессирования «классической» формы болезни Гентингтона, при этом происходит трансформация клинической картины гиперкинетического синдрома в брадикинезию (замедленность движений) с мышечной скованностью. Примерно у 10 % взрослых пациентов болезнь начинается с акинетико-ригидного синдрома (движения скованные, трудно начать действие, медлительность во всем) с минимальными проявлениями хореи .
3. Психическая. Эта форма не является самостоятельной и выделяется лишь при резком преобладании психических симптомов над неврологической симптоматикой.
Чтобы оценить степень выраженности функциональных нарушений при патологии, разработана Унифицированная шкала оценки болезни Гентингтона (United Huntington’s Disease Rating Scale, UHDRS).
Компоненты UHDRS
- Двигательная оценка.
- Когнитивная оценка.
- Оценка поведенческих нарушений.
- Оценка функциональных возможностей.
- Оценка общей функциональной способности (TFC).
В зависимости от оценки по шкале общей функциональной способности (TFC), болезнь Гентингтона имеет следующую классификацию:
| Общий балл TFC | Стадия БГ | Общая характеристика |
|---|---|---|
| 11-13 | 1 | Ранние стадии: Появляются единичные двигательные нарушения: лёгкие неконтролируемые движения, незначительное изменение координации и походки, забывчивость, раздражительность. |
| 7-10 | 2 | |
| 4-6 | 3 | Стадия умеренных клинических проявлений: Присоединяются психические нарушения: нарушение речи и глотания, снижение аппетита и веса, становятся более выраженными неконтролируемые движения. |
| 1-3 | 4 | Поздние стадии, или стадии развёрнутых клинических проявлений: Появляются выраженные симптомы (двигательные и психические), пациент инвалидизируется, нуждается в посторонней помощи, появляются депрессия, галлюцинации, панические расстройства. |
| 0 | 5 |
Осложнения хореи Гентингтона
- Аспирационная пневмония — воспаление которое развивается, когда в просвет лёгких попадают инородные вещества, например рвотные массы.
- Сепсис — опасное для жизни инфекционное заболевание человека, которое развивается в ответ на проникновение в кровь инфекционных агентов или их токсинов.
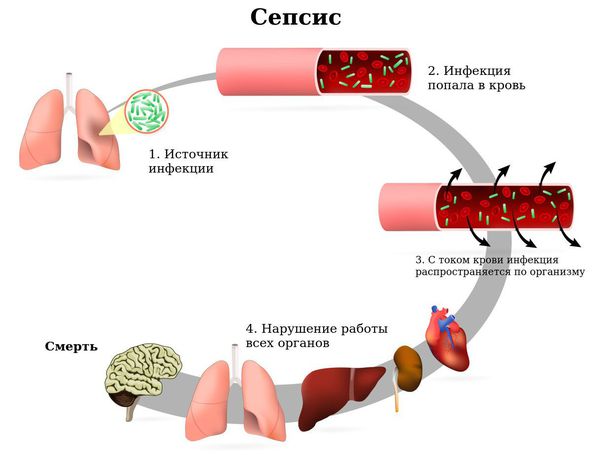
Сепсис
- Кахексия — истощение, которое возникает на фоне отказа от еды или нарушения глотания.
- Нарушения работы сердечно-сосудистой системы из-за закупорки артерий.
- Суицид в результате психических нарушений .
Диагностика хореи Гентингтона
Около 90 % диагнозов болезни Гентингтона, основанных на семейном анамнезе и выявлении характерных симптомов, подтверждаются генетическим исследованием. Поэтому сбор семейного анамнеза является обязательным при осмотре пациента с хореей.
Наиболее оптимальным методом диагностики является молекулярно-генетическое исследование. Для выявления мутации гена, ассоциированного с развитием хореи Гентингтона, требуется забор крови из вены. Анализ ДНК позволяет установить аномальное количество ЦАГ-повторов в гене HTT, что является непосредственной причиной развития болезни. С помощью этого метода можно подтвердить диагноз у больного и выявить носителей патологического гена среди родственников на доклинической стадии.
Аномальное количество ЦАГ-повторов в гене HTT не подтверждает диагноз, так как может быть получен задолго до появления первых симптомов. Нормальное количество ЦАГ-повторов в гене HTT говорит о том, что человек никогда не заболеет данной патологией.
При КТ головного мозга у пациентов с болезнью Гентингтона определяется расширение боковых желудочков и субарахноидальных пространств (между мозговыми оболочками, заполненными спинномозговой жидкостью). Характерно развитие гидроцефалии (избыточного скопления спинномозговой жидкости в желудочках головного мозга), при этом её степень будет зависеть от тяжести заболевания.
На МРТ можно отметить выраженную атрофию головок хвостатых ядер и расширение боковых желудочков, особенно в области передних рогов.
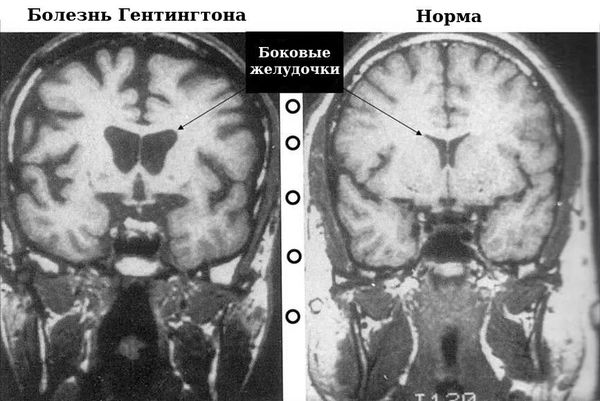
МРТ. Мозг при болезни Гентингтона и в норме.
Однофотонная эмиссионная компьютерная томография (ОФЭКТ, англ. — SPECT) является более чувствительным и специфичным методом для постановки диагноза хореи Гентингтона: после введения радиофармпрепарата (РФП) выявляется снижение метаболизма глюкозы в хвостатых ядрах. Иногда эти изменения можно обнаружить на доклинической стадии болезни. Такие же признаки выявляются и при позитронно-эмиссионной томографии (ПЭТ) .
Количественная электроэнцефалография (ЭЭГ) — неинвазивный и относительно недорогой метод, в основе которого лежит регистрация электрической активности нейронов, которая представляет собой базовый механизм их взаимодействия. Ритмы ЭЭГ, в частности α- и θ-ритмы, отражают нейрофизиологические процессы, участвующие в обеспечении когнитивных функций .
Ритмы ЭЭГ:
- α-ритмы — регистрируется у человека в условиях физического и умственного покоя при закрытых глазах и отсутствии внешних раздражений.
- β-ритмы — регистрируются при открывании глаз, умственной работе и других раздражителях.
- θ-ритмы — наблюдается в состоянии неглубокого сна, при кислородном голодании мозга и наркозе.
- δ-ритмы — отмечаются во время глубокого сна.
Изменения на ЭЭГ у пациентов с болезнью Гентингтона характеризуются значимым снижением спектральной мощности α-ритма и повышением относительной спектральной мощности β- и δ-активности. Изучению данных ЭЭГ у асимптомных носителей мутаций в гене HTT посвящено небольшое количество работ, и их результаты неоднозначны.
Лабораторные анализы при болезни Гентингтона могут существенно не отличаться от нормы. При специальном биохимическом анализе крови иногда обнаруживается снижение концентрации некоторых компонентов:
- гамма-аминомасляной кислоты (ГАМК) — важнейшего тормозного нейромедиатора центральной нервной системы;
- глутаматдекарбоксилазы — фермента, необходимого для синтеза ГАМК;
- холин-ацетилтрансферазы — фермента, участвующего в синтезе нейромедиатора нервного возбуждения — ацетилхолина .
При исследовании спинномозговой жидкости нередко отмечается повышение содержания белка.
Дифференциальный диагноз. Существует ряд заболеваний, которые в некоторых случаях сопровождаются хореей с когнитивными и (или) психическими нарушениями и напоминают болезнь Гентингтона: болезнь Вильсона — Коновалова, болезнь Фридрейха, хореоакантоцитоз, спиноцеребеллярные атаксии и др.
Лечение хореи Гентингтона
Болезнь Гентингтона считается неизлечимым заболеванием, поэтому терапия является симптоматической и поддерживающей. Несмотря на это, благодаря лечению можно значительно улучшить качество жизни пациентов .
В настоящее время ведущую роль в лечении двигательных нарушений при болезни Гентингтона играет тетрабеназин. Это новый препарат, схожий по своим свойствам с атипичными нейролептиками . Если нет выраженных психических проявлений болезни (в первую очередь депрессий, суицидальных мыслей, раздражительности, агрессивного поведения) и нарушения глотания, то этот препарат нужно рассматривать как средство первого выбора для лечения хореи при болезни Гентингтона.
В других случаях рационально рассмотреть возможность применения нейролептиков, т. е. антипсихотиков (в первую очередь атипичных — клозапин, кветиапин, рисперидон) в виде монотерапии или в сочетании с противоэпилептическими препаратами или бензодиазепинами .
Препараты вальпроевой кислоты (Депакин, Конвулекс и др.), известные как антиконвульсанты, применяются при наличии мышечных спазмов.
Коррекцию психических нарушений следует проводить при помощи лекарственных препаратов, применяемых в психиатрии.
По данным некоторых клинических случаев, могут быть эффективны высокие дозы клоназепама . Этот короткодействующий препарат из группы бензодиазепинов чаще применяется в качестве вспомогательной терапии, если у пациента присутствует тревога. Кроме того, клоназепам назначается для коррекции миоклоний, дистонии и при нарушениях сна .
При необходимости врач назначает антидепрессанты, препаратами выбора являются ингибиторы обратного захвата серотонина благодаря небольшому числу побочных эффектов и отсутствию опасности передозировки (сертралин, эсциталопрам).
Пациентам с болезнью Гентингтона пытались проводить операции глубокой стимуляции мозга с имплантацией электродов во внутренний сегмент бледного шара (парной структуры переднего мозга, которая является перекрёстком выбора действия). При этом наблюдалось снижение выраженности хореических гиперкинезов, но отмечалось нарастание расстройств ходьбы, брадикинезии и когнитивных нарушений .
Есть данные о трансплантации в мозг пациентов с болезнью Гентингтона эмбриональных и стволовых клеток , но результаты такой экспериментальной терапии нуждаются в тщательной оценке.
В настоящее время в мире ведутся многоцентровые клинические исследования генной терапии у пациентов с хореей Гентингтона. Заболевание создаёт большие медико‐социальные проблемы, так как к моменту первых проявлений болезни люди успевают завести детей и передать им патологию, не подозревая об этом. В связи с этим необходима разработка новых методов диагностики и лечения, что делает актуальным дальнейшее изучения БГ и особенностей её течения.
Прогноз. Профилактика
Учитывая тот факт, что заболевание неуклонно прогрессирует, можно сделать вывод о неблагоприятном прогнозе. Средняя продолжительность жизни с момента появления гиперкинеза составляет 15-20 лет . При ювенильной форме пациенты живут меньше.
Пациенты погибают не от самой болезни, а от её осложнений. Например, пневмония может стать смертельной из-за ослабленного иммунитета пациента. Иммунитет, в свою очередь, снижен из-за истощения пациента, который по причине проблем с глотанием мало принимает пищу. Травмы могут стать смертельными в результате нарушения движений и изменения походки. Частой причиной гибели пациентов является суицид .
Чем больше осведомлен пациент о своем заболевании, тем больше шансов своевременно получить необходимую терапию у врача невролога и предотвратить быстрое развитие болезни и осложнений.
Для профилактики заболевания в семьях с отягощённым анамнезом обязательно проведение медико-генетического консультирования для определения генетического статуса близких родственников и прогноза по заболеванию у потомства. Ввиду высокого риска повтора заболевания в семье с отягощённым анамнезом, в качестве профилактики рекомендуется проведение пренатальной диагностики или доимплантационного генетического тестирования эмбрионов (ПГТ-М), что обсуждается в рамках медико-генетического консультирования семьи.
Список литературы
- Krack P. Relics of dancing mania: the dancing procession of Echternach // Neurology. — 1999; 53: 2169-2172.ссылка
- Huntington G. On Chorea // Medical and Surgical Reporter. — 1872; 26 (15): 317-321.
- Бунятян Н. Д. и др. Орфанные лекарственные препараты: США, Европейский союз и Россия // Ремедиум. — 2013. — № 11. — С. 47-52.
- Revilla F. J., Grutzendler J. Huntington disease // Medscape. — 2005.
- Платонов Ф. А., Иллариошкин С. Н., Кононова С.К. и др. Спиноцеребеллярная атаксия первого типа в Якутии: распространенность и клинико-генетические сопоставления // Мед. генет. — 2004. — № 5. — С. 242-248.
- Иллариошкин С. Н. Ранние (додементные) формы когнитивных расстройств // Consilium Medicum. — 2007. — № 2. — С. 107-111.
- Иллариошкин С. Н., Иванова-Смоленская И. А., Маркова Е. Д. Новый механизм мутации у человека: экспансия тринуклеотидных повторов // Генетика. — 1995. — № 11. — С. 1478-1489.
- Экстрапирамидные расстройства вчера, сегодня, завтра / под ред. проф. О. С. Левина. — М., 2013.
- Kremer B. Clinical neurology of Huntington’s disease // Huntington’s Disease (Oxford Monographs on Medical Genetics). 3rd ed. / Ed. by G. Bates et al. N.Y. — 2002. — P. 30.
- Novak M. J., Tabrizi S. J. Huntingtons disease // BMJ. — 2010; 340: c3109.
- Современные подходы к медикаментозной коррекции хореи при болезни Гентингтона / Ю. А. Селиверстов, С. А.Клюшников. — 2014. — № 3. — С. 24-28.
- Bjorkqvist M., Wild E. J., Thiele J. et al. A novel pathogenic pathway of immune activation detectable before clinical onset in Huntington’s disease // J. Exp. Med. — 2008; 205(8): 1869-1877.ссылка
- Иллариошкин С. Н., Иванова-Смоленская И. А., Маркова Е. Д. Новый механизм мутации у человека: экспансия тринуклеотидных повторов // Генетика. — 1995. — № 31. — С. 1478-1489.
- Shoulson I. et al. Assessment of functional capacity in neurodegenerative movement disorders: Huntington’s disease as a prototype // Quantification of neurologic deficit. Boston: Butterworths. — 1989. — C. 271-283.
- Болезнь Гентингтона. Клинические рекомендации / С.Н. Иллариошкин, С. А. Клюшников, Селиверстов Ю. А. — 2017.
- Ювенильная болезнь Гентингтона / Г.Е. Руденская, Н. М. Галеева, Д. А. Саввин, В. П. Федотов, С. А. Курбатов, А. В. Поляков. — 2010. — Т. 4, № 2.
- Иллариошкин С. Н. Конформационные болезни мозга. — М.: Янус-К, 2003.
- Hayden M. R., Martin W. R. W., Stoessl A. J., Clark C., Hollenberg S., Adam M. J., Ammann W., Harrop R., Rogers J., Ruth T., Sayre C., Pate B. D. Positron emission tomography in the early diagnosis of Huntington’s disease // Neurology. —1986; 36(7): 888-894.ссылка
- Klimesch W. EEG alpha and theta oscillations reflect cognitive and memory performance: a review and analysis // Brain Res. Brain Res. Rev. — 1999; 29 (2-3): 169-195.ссылка
- Klimesch W. α-band oscillations, attention, and controlled access to stored information // Trends Cogn. Sci. — 2012; 16(12): 606-617.ссылка
- Huff J. S. Huntington Chorea // Medscape. — 2005.
- Roos R. A. Huntington’s disease: a clinical review // Orphanet J. Rare Dis. — 2010; 5: 40.ссылка
- Armstrong M. J., Miyasaki J. M. Evidence-based guideline: pharmacologic treatment of chorea in Huntington disease. Report of the Guideline Development Subcommittee of the American Academy of Neurology // Neurology. — 2012; 79(6): 597-603.ссылка
- Emma M. Coppen, Raymund A. C. Roos Current Pharmacological Approaches to Reduce Chorea in Huntington’s Disease // Drugs. — 2017; 77(1): 29-46.ссылка
- Peiris J. B., Boralessa H., Lionel N. D. Clonazepam in the treatment of choreiform activity // Med J. Aust. — 1976; 1: 225-227. ссылка
- Mestre T. A., Ferreira J. J. An evidence-based approach in the treatment of Huntington’s disease // Parkinsonism Relat Disord. — 2012; 18: 316-320. ссылка
- Novak M. J., Tabrizi S. J. Huntington’s disease: clinical presentation and treatment // Int Rev Neurobiol. — 2011; 98: 297-323. ссылка
- Kang G. A., Heath S., Rothlind J., Starr P. A. Longterm follow-up of pallidal deep brain stimulation in two cases of Huntington’s di sease // J. Neurol. Neurosurg. Psychiatry. — 2011; 82(3): 272-277.ссылка
- Dunnett S. B., Rosser A. E. Stem cell transplantation for Huntington’s disease // Exp. Neurol. — 2007; 203(2): 279-92. ссылка
- Клюшников С. А., Юдина Е. Н., Иллариошкин С. Н., Иванова-Смоленская И.А. Психические нарушения при болезни Гентингтона // Неврология. Нейропсихиатрия. Психосоматика. — 2012.
- Sex-dependent mechanisms for expansions and contractions of the CAG repeat on affected Huntington disease chromosomes / B. Kremer, E. Almqvist, J. Theilmann, N. Spence, H. Telenius, Y. P. Goldberg, M. R. Hayden // Am J Hum Genet. — 1995; 57(2): 343-350.ссылка
- Harry T. Orr, Huda Y. ZoghbiTrinucleotide repeat disorders // Annu Rev Neurosci. — 2007; 30: 575-621.ссылка
- McNeil J. B., Zhang F., Taylor B. V., Sinclair D. A., Pearlman R. E., Bognar A. L. Cloning, and molecular characterization of the GCV1 gene encoding the glycine cleavage T-protein from Saccharomyces cerevisiae // Gene. — 1997; 186(1): 13-20.ссылка
- Raymund AC Roos Huntington’s disease: a clinical review // Orphanet J Rare Dis. — 2010; 5: 40.ссылка
- Huntington Disease / Nicholas S. Caron, Galen E. B. Wright, Michael R. Hayden // University of Washington, Seattle, 1993-2020.ссылка