Лобно-височная деменция (Frontotemporal dementia) — это прогрессирующее нейродегенеративное заболевание, при котором возникает тяжёлая очаговая атрофия лобных и передних височных долей, отвечающих за контроль речи и поведения, способность планировать и организовывать свои действия.
Лобно-височная деменция
В отдельных участках этих долей происходит повреждение нейронов и они замещаются вспомогательными нервными клетками — глией . Чаще всего это связано с отложением тау-белка или ДНК-связывающего белка-43 (TDP-43).
Распространённость
Лобно-височная деменция (ЛВД) — это вторая по частоте разновидность деменции, дебютирующая в молодом возрасте . По разным данным, заболеваемость ЛВД составляет от 1,6 до 4,1 случая на 100 000 человек в год . Мужчины и женщины страдают ЛВД одинаково.
Средний возраст начала заболевания — от 45 до 65 лет, но встречаются случаи, когда такая деменция развивается у пациентов моложе 30 лет и у пожилых людей . Например, в возрасте около 65 лет это заболевание было выявлено у актёра Брюса Уиллиса . Некоторые предполагают, что у него болезнь Пика — разновидность ЛВД.
Поведенческий вариант болезни (пЛВД) встречается в четыре раза чаще, чем речевой (первично-прогрессирующая афазия, ППА) . На пЛВД приходится примерно 60 % случаев, остальные 40 % являются речевыми вариантами .
Причины лобно-височной деменции
Лобно-височная деменция в основном развивается из-за генетических факторов (случайных и наследственных генетических мутаций), а в остальных случаях причину так и не удаётся установить. Около 20 % случаев вызваны случайной генетической мутацией, но примерно у 40 % пациентов родственники тоже страдали деменцией, психическими заболеваниями или двигательными расстройствами, например тремором, спазмами и внезапными сокращениями мышц (дистонией и миоклонусом) .
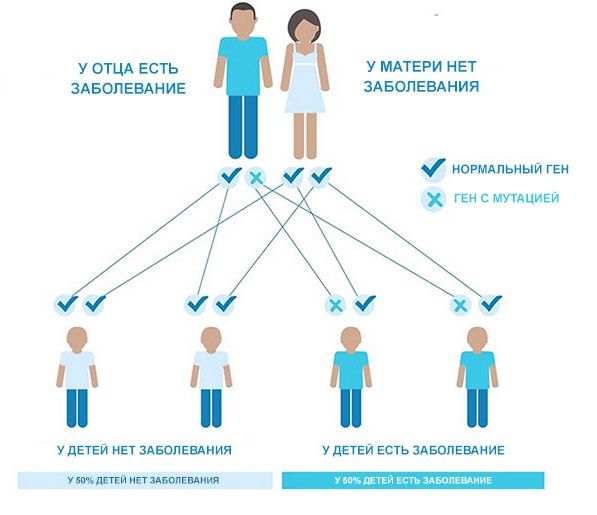
Большинство генетических причин наследуются по аутосомно-доминантному типу, т. е. достаточно, чтобы генетический дефект был хотя бы у одного из родителей.
Аутосомно-доминантный тип наследования
Члены одной семьи могут страдать от целого спектра расстройств БДН (болезней двигательного нейрона): только ЛВД, только БДН или их комбинации. ЛВД в сочетании с БДН наследуется наиболее часто, а в сочетании с речевыми нарушениями (в частности с семантическим вариантом) реже всего .
С ЛВД чаще всего связаны мутации в генах C9ORF72, MAPT и GRN, реже в генах VCP, CHMP2B, TARDBP, FUS, EXT2, TBK1 и SQSTM1. От того, какой ген повреждён, зависит выраженность симптомов болезни.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы лобно-височной деменции
В зависимости от формы (поведенческой или речевой) заболевание начинается по-разному, а его симптомы могут напоминать проявления множества психических расстройств, например шизофрении и биполярного аффективного расстройства. Всё это может затруднять диагностику.
В зависимости от формы (поведенческой или речевой) заболевание может начинаться с различных симптомов. В целом при ЛВД изменяется личность больного, его поведение становится асоциальным, иногда нелогичным и вызывающим. Окружающие и близкие люди часто не могут понять, что с ним происходит, потому что человек начинает вести себя абсолютно нетипично, например перестаёт справляться с работой, которую раньше делал с лёгкостью, вставляет абсолютно неуместные комментарии (например, открыто заигрывает с подругами жены), становится холодным по отношению к самым близким людям .
Также появляются проблемы с речью: трудности в подборе слов, нарушение плавности речи, сложности с пониманием фраз и называнием предметов, а иногда и полная потеря речи. Кроме того, может ухудшаться распознавание лиц. При этом память страдает в меньшей степени, ориентация на местности и двигательные функции относительно сохранны. Поэтому окружающим часто кажется, что человек будто стал совсем другим, но они не могут понять, что же привело к такой кардинальной перемене.
Патогенез лобно-височной деменции
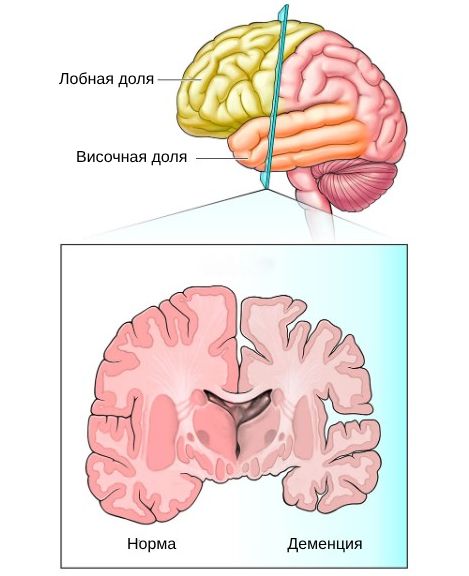
Развитие ЛВД связано с изменениями в головном мозге — атрофией лобных и передних височных долей, а также микроскопическими изменениями: потерей нервных клеток и связей между ними (синапсов) с замещением нейронов соединительной тканью . Эти макро- и микроскопические изменения примерно одинаковы при всех формах заболевания.
Нейроны и синапс
Почти во всех случаях ЛВД в тканях мозга встречается один из трёх специфических белков:
- дефектного тау-белка (40–45 %);
- ДНК-связывающий белок TAR-43 (TDP-43, 40–45 %);
- или FUS (fused in sarcoma, 5 %) .
Тау-белок кодируется геном MAPT на 17-й хромосоме и играет важную роль в сборке мономеров тубулина в микротрубочки — важные структуры внутри нейронов, которые поддерживают их форму и функцию, а также участвуют в транспорте молекул и органелл между разными частями нервной клетки. Изменения в структуре тау-белка приводят к агрегации (скоплению) этих белков и поражению нейронов .
Атрофия при ЛВД начинается в передней лобной коре и гиппокампе, затем вовлекается орбитофронтальная кора, базальные ганглии и задняя височная доля. Впоследствии это приводит к прогрессированию лобной и височной атрофии и поражению белого вещества, а затем к тяжёлой атрофии в лобно-височной области, гиппокампе, таламических и базальных ганглиях . Поэтому симптомы болезни возникают и усугубляются постепенно, и чем дольше существует болезнь, тем больше становится площадь атрофии и тяжелей протекает деменция.
Классификация и стадии развития лобно-височной деменции
Существует два основных варианта ЛВД:
- поведенческий (пЛВД) — в первую очередь меняется поведение и черты личности;
- речевой вариант, или первично-прогрессирующая афазия (ППА) — постепенно ухудшается способность понимать речь, подбирать слова и строить предложения, поведение существенно не меняется .
Сначала появляются симптомы одной из этих форм, но на поздних стадиях присоединяются признаки и второй, однако доминирует всё равно только одна.
Поведенческий вариант лобно-височной деменции (пЛВД)
Заболевание начинается с изменений в поведении, чертах личности, эмоциях, контроле и планировании действий . Появляется расторможенность, импульсивность и апатия, нарушается питание, пропадает сочувствие. Расторможенность проявляется социально неприемлемым поведением: вторжением в личное пространство других людей, неуместными прикосновениями или чрезмерной общительностью с незнакомцами. Человек перестаёт соблюдать социальные нормы, например может шутить о внешнем виде окружающих, без смущения использовать матерные слова и грубые выражения. При этом он думает, что ведёт себя как обычно, и не понимает, почему близкие возмущены его поведением .
Также пациент может совершать импульсивные, необдуманные и преступные действия: играть в азартные игры, воровать, принимать неверные решения без учёта последствий (например, купить одинаковые мотоциклы для себя и своего 7-летнего сына). Преступное поведение наблюдается у 37–54 % больных ЛВД .
Апатия у таких пациентов может протекать по-разному:
- аффективная апатия проявляется равнодушием или безразличием;
- при моторной форме человек меньше двигается;
- при когнитивной — теряет мотивацию к действиям, которые требуют сосредоточенности и усилий .
Также апатия может проявляться нежеланием общаться с другими людьми, выполнять семейные обязанности или заниматься хобби. Пациента приходится побуждать, чтобы он выполнял домашние дела, продолжал разговор или даже двигался. Апатию легко принять за депрессию.
Другие симптомы включают бесчувственность, отсутствие эмпатии и интереса к окружающим или жестокие комментарии по отношению к ним. Часто проявляется безразличие к собственному диагнозу и его влиянию на других, что получило название «лобная анозодиафория» .
Также может наблюдаться упорное, стереотипное или компульсивное поведение — непреодолимая тяга совершать одни и те же действия . К простым движениям относятся постукивание, хлопанье в ладоши, растирание, ковыряние и причмокивание губами. Более сложное поведение может включать сбор окурков, подсчёт каких-либо предметов, ходьбу по установленным маршрутам или повторяющиеся походы в туалет (т. е. очень часто и не по нужде), но у каждого пациента свои ритуалы. Речь также может стать стереотипной — человек начинает повторять определённые слова и фразы.
Кроме того, могут значительно поменяться пищевые привычки и появиться навязчивое желание что-то попробовать или постоянно жевать. Часто меняются предпочтения в еде, особенно распространена тяга к сладкому, что приводит к набору веса . Пациенты могут переедать, даже несмотря на чувство сытости . По мере того как человек становится более расторможенным, он может хватать еду с чужих тарелок, а позже пытаться съесть несъедобные предметы.
Поведенческие симптомы пЛВД связаны с нарушениями в паралимбических областях, включая медиально- и орбитально-лобную, переднюю поясную и островковую кору . Расторможенность связана с дегенерацией правой орбитальной лобной коры . Таким образом, по симптомам врач может заподозрить, какая именно область мозга поражена, поэтому очень важен тщательный сбор анамнеза (истории болезни).
Многие первые симптомы пЛВД можно спутать с проявлениями психических заболеваний, из-за чего пациентам часто ставят ошибочный диагноз .
Первичная прогрессирующая афазия (ППА)
Первичная прогрессирующая афазия подразделяется на семантический (сППА), аграмматический (аППА) и логопенический вариант (лППА) . Логопеническая форма характерна и для других видов деменции, например для болезни Альцгеймера, а сППА и аППА считаются вариантами ЛВД.
Основной симптом всех форм ППА в первые два года болезни — это нарушение речи.
Семантический вариант ППА (сППА). При поражении левой височной доли пациент постепенно перестаёт понимать смысл слов , в первую очередь редко используемых, например таких как «жираф». Вместо нужного слова человек подбирает объяснение, например «животное с длинной шеей». При этом больной помнит часто употребляемые слова, такие как «собака». При сППА человек не повторяет одни и те же слова и фразы, отсутствует апраксия речи, когда из-за проблем с произношением звуков, слогов и слов человек может по-разному произносить одно и то же слово. Синтаксис и грамматика тоже не страдают. Если вовлечены медиальные височные доли, может нарушаться память. При этом обычно сохраняется исполнительная функция (способность планировать, принимать решения, управлять вниманием, контролировать поведение и координацию движений) и зрительно-пространственные навыки (ориентация на местности, восприятие себя и предметов в пространстве) .
Если сначала поражается правая височная доля, то преобладают поведенческие симптомы. Такие пациенты держат эмоциональную дистанцию, избегают общения, могут стать раздражительными. У них появляются причудливые изменения в одежде, нарушается сон, пропадает аппетит и либидо . Они могут не понимать, что причиняют дискомфорт окружающим, что некоторые действия не допустимы в обществе, например могут ковырять в носу, задирать юбку и т. д. У них может замедляться мышление, они «застревают» на одной мысли и не могут переключиться. Могут рассказывать многословные истории, перебивать и не улавливать социальные сигналы: недовольные взгляды окружающих или как другие отсаживаются от них. Не реагируют на замечания о том, что ведут себя неадекватно. Считается, что пациенты не улавливают социальные сигналы из-за того, что перестают распознать эмоции на лицах. Этот симптом связан с прогрессирующей атрофией правой миндалины .
У пациентов как с левой, так и с правой височной сППА могут появиться компульсии — непреодолимая тяга совершать стереотипные действия. У больных правосторонней сППА они возникают вокруг слов и символов (постоянный подсчёт чего-либо, повтор каких-то слов и т. д.) .
С течением времени вовлекаются обе височные доли и развивается и та, и другая группа симптомов . Через 5–7 лет поражаются структуры лобной доли и появляются симптомы пЛВД, такие как расторможенность, изменение предпочтений в еде и набор веса .
У пациентов с левой височной сППА иногда развиваются способности к рисованию, музыке и садоводству .
Среди всех форм лобно-височной деменции сППА реже всего вызван генетическими причинами .
Аграмматическая ППА (аППА). При такой форме деменции пациенты проявляют речевую апраксию, каждый раз повторяя одно и то же слово по-разному . Часто такие больные неправильно строят предложения, но иногда на ранних стадиях этот симптом незаметен или даже отсутствует. Пациенты могут перестать говорить, но всё ещё могут правильно писать. Однако со временем аграмматизм начинает затрагивать как устную, так и письменную речь. Апраксии или аграмматизму часто предшествует чрезмерная говорливость .
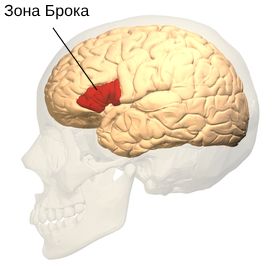
Симптомы аППА связаны с зоной Брока в левой нижней лобной извилине и передней части островковой доли .
Зона Брока
Полное отсутствие речи при аППА возникает, если на ранних стадиях происходит более крупное поражение, выходящее за пределы типичной нижней лобной и островной областей . Обычно, по крайней мере на ранних стадиях, пациентам трудно подбирать слова, но социальные нормы они не нарушают. Понимание речи, как правило, не меняется, за исключением длинных и сложных предложений. Может незначительно нарушаться исполнительная функция, но память и зрительно-пространственные навыки на ранних стадиях относительно сохранны .
Осложнения лобно-височной деменции
К сожалению, как и все остальные виды деменций, ЛВД будет неуклонно прогрессировать, пока не разовьётся тотальная деменция и человек не сможет двигаться. Лежачие больные подвержены воспалительным заболеваниям, особенно пневмонии, из-за которой они чаще всего и погибают. Также без должного ухода у них могут развиться пролежни.
К другим возможным осложнениям относят проблемы со сном (бессонницу и дневную сонливость), синдром беспокойных ног, нарушение дыхания во сне и травмы из-за частых падений .
Диагностика лобно-височной деменции
При подозрении на ЛВД нужно обратиться к неврологу, а при выраженных психических нарушениях и асоциальном поведении — к психиатру.
Пока не существует лабораторных анализов, по которым можно было бы диагностировать ЛВД. Недавно учёные смогли измерить уровни определённых биомаркеров в сыворотке и спинномозговой жидкости и выявить связь между ними и различными типами нейродегенеративных заболеваний. Тем не менее эти показатели представляют пока исключительно научный интерес и не используются в медицинской практике.
Основными методами диагностики ЛВД остаётся сбор анамнеза и магнитно-резонансная томография (МРТ) головного мозга, но на их основании всё равно нельзя поставить точный диагноз. В связи с этим в сомнительных случаях может потребоваться иммуногистохимия и генетическое тестирование. Также проводится физикальное обследование, позволяющее оценить чувствительность и рефлексы, а в сомнительных случаях, чтобы отличить ЛВД от других заболеваний, может потребоваться электромиография (ЭМГ).
ЭМГ
Сбор анамнеза
Для получения объективной информации о характерных симптомах может проводиться беседа с родственниками пациента. Чтобы оценить наследственную предрасположенность, врач уточнит у пациента и/или членов семьи, сталкивались ли их близкие родственники со стремительной переменой в поведении, речи или быстрым развитием двигательных нарушений .
Инструментальные методы
С помощью МРТ можно диагностировать ЛВД и исключить другие болезни, такие как опухоли или цереброваскулярные заболевания, например атеросклероз. Однако точный диагноз на основании осмотра и МРТ можно поставить только примерно в 60 % случаев .
При описании снимков врач обратит внимание на наличие атрофии в отдельных участках — передней части островка и поясной извилины, орбитофронтальной, дорсолатеральной префронтальной и передней височной доли.
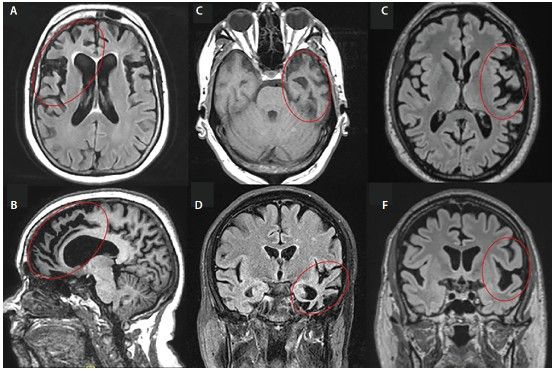
МРТ при ЛВД: А, Б — пЛВД; C, D — сППА; E, F — аППА [70]
МРТ может указывать и на другие виды деменции:
- асимметричная и выраженная атрофия участков префронтальной коры (дорсолатеральных и орбитофронтальных зон), часто называемая «лезвием ножа», позволяет заподозрить болезнь Пика;
- атрофия среднего мозга и минимальная церебральная атрофия указывают на прогрессирующий надъядерный паралич;
- слегка асимметричная дорсальная атрофия, затрагивающая премоторную область, указывает на кортикобазальную дегенерацию.
ПЭТ с селективным радиоизотопом 18F (флортауципиром) может помочь различить болезнь Альцгеймера (БА) и ЛВД, так как это вещество, по-видимому, связывается с нейрофибриллярными клубками при БА и хорошо коррелирует с клиническими симптомами. Однако результат такого исследования не всегда оказывается верным . К тому же оно дорого стоит, поэтому практически не используется.
Генетическое тестирование
Наиболее часто при ЛВД встречаются мутации в генах, кодирующих связанный с микротрубочками тау-белок (ген МАРТ), белок програнулин (PGRN), ДНК-связывающий протеин TDP-43 (TARDBP), белок, ассоциированный с саркомой (FUS), а также мутация в гене C9ORF72 .
Дифференциальная диагностика
ЛВД может сочетаться с болезнью двигательного нейрона (БДН): у 15 % пациентов с ЛВД и у 30 % с БДН эти два синдрома встречаются вместе . Т. е. ЛВД и БДН — это два разных заболевания с разным лечением, которые невозможно перепутать, но они могут сочетаться друг с другом. Если у пациента с ЛВД наблюдаются подёргивания мышц, мышечная слабость, проблемы с глотанием, спастический тонус, повышенные рефлексы или патологический смех или плач, врач может заподозрить БДН и назначить проведение ЭМГ. Если у пациентов с БДН проявляются симптомы, относящиеся к пЛВД, то показано нейропсихологическое обследование: исследование памяти, внимания, мышления и других психических процессов.
Лобно-височную деменцию следует отличать от кортикобазальной дегенерации и прогрессирующего надъядерного паралича.
Для постановки диагноза «кортикобазальная дегенерация (КБД)» необходимо, чтобы у пациента было хотя бы два асимметричных двигательных симптома:
- напряжение в мышцах рук или ног (ригидность);
- невозможность двигаться или замедление движений (акинезия);
- непроизвольные и иногда болезненные движения (дистония);
- быстрые и непроизвольные сокращения мышц (миоклонус).
Также должны присутствовать два из следующих высших корковых симптомов:
- нарушение координации мышц рта и языка (оробуккальная апраксия);
- трудности с координацией движений (апраксия конечностей);
- невозможность ощущать и интерпретировать сенсорные сигналы — боль, температуру, давление и т. д. (корковый сенсорный дефицит);
- неспособность контролировать руку или ногу (синдром «чужой» конечности) .
Для КБД характерна асимметрия симптомов, т. е. они больше выражены в правых или левых конечностях, но это свойственно и всем другим нейродегенеративным заболеваниям, в том числе ЛВД . КБД может начинаться как пЛВД, аППА и исполнительное двигательное расстройство (трудности в выполнении двигательных задач, нарушение координации движений и другие связанные с движениями проблемы) . Как правило, у пациентов сначала возникают поведенческие, речевые или исполнительные нарушения, что приводит к подозрению на пЛВД или аППА. Затем у них нарушаются движения, часто проявляется паркинсонизм (тремор, нарушение равновесия, падения, замедление движений) с ригидностью мышц, идущих вдоль позвоночника . Поэтому если в начале болезни нет двигательных нарушений, то исключать КБД всё равно нельзя . Чтобы отличить эти заболевания, нужно регулярно посещать врача и при возникновении нетипичных для ЛВД симптомов пройти дополнительное обследование, которое назначит доктор.
Прогрессирующий надъядерный паралич (ПНП), ранее известный как синдром Стила — Ричардсона — Ольшевского, представляет собой сочетание следующих симптомов:
- ограничения взгляда вверх или вниз, реже вправо или влево (вертикального или горизонтального надъядерного паралича взора);
- боли и напряжения мышц, идущих вдоль позвоночника (аксиальной ригидности);
- невнятности речи (дизартрии);
- частых падений;
- нарушения глотания, речи и мимики (псевдобульбарного паралича);
- лёгкой деменции с изменениями личности и психиатрическими симптомами.
У пациентов может преобладать исполнительная дисфункция (проблемы с планированием, организацией, контролем, мотивацией и выполнением задач), изменения личности, снижение скорости мышления и дефицит внимания, что приводит к ошибочной диагностике лобной атрофии . Больные с симптомами лобной дисфункции, но без падений или надъядерного паралича взора в течение первого года болезни, вероятно входят в число 20 % пациентов с ПНП, которым ошибочно поставлен диагноз. Однако со временем симптомы пЛВД или аППА могут прогрессировать в ПНП или, наоборот, начальные проявления ПНП могут развиться в пЛВД или аППА .
Также потребуется дифференциальная диагностика с психическими расстройствами, например шизофренией и биполярным аффективным расстройством. Её должен проводить психиатр.
Лечение лобно-височной деменции
Лечения ЛВД в настоящее время не существует, но для коррекции симптомов можно использовать фармакологические и поведенческие методы.
Медикаментозное лечение
Препараты для лечения болезни Альцгеймера не показали положительного эффекта при ЛВД. Так, ингибиторы ацетилхолинэстеразы даже ухудшают состояние при ЛВД . Мемантин, который тоже используют при болезни Альцгеймера, неплохо переносится пациентами с ЛВД, но в двойном слепом плацебо-контролируемом исследовании не было выявлено положительного влияния на поведение или когнитивные функции таких больных .
Есть мнение, что симптомы при ЛВД можно облегчить с помощью селективных ингибиторов обратного захвата серотонина (СИОЗС) . Небольшое рандомизированное плацебо-контролируемое двойное слепое исследование Тразодона (антидепрессанта, близкого по механизму действия к СИОЗС) показало улучшение поведенческих показателей у пациентов с ЛВД, но не повлияло на когнитивные нарушения .
Атипичные нейролептики следует использовать с осторожностью, так как у пациентов с ЛВД повышен риск экстрапирамидных побочных эффектов (паркинсонизма, дистонии, тремора и т. д.) .
Доказательства пользы нормотимиков при ЛВД ограничены .
Окситоцин (синтетический гормональный препарат), предположительно, может использоваться в качестве терапии, нацеленной на эмоциональные нарушения при ЛВД. Небольшое исследование показало некоторое улучшение нейропсихиатрического статуса после его использования .
Как ухаживать за человеком с лобно-височной деменцией
Также для коррекции симптомов ЛВД важно соблюдать общие принципы по уходу за пациентом с деменцией:
- установить режим, но пытаться при этом сохранить привычные занятия пациента;
- давать человеку простые задания;
- поддерживать его независимость — пациент должен выполнять все посильные действия сам;
- позаботиться о безопасности дома;
- добавить в жизнь пациента физические упражнения и посильную умственную нагрузку;
- дарить положительные эмоции;
- узнавать больше о деменции;
- принимать чувства человека;
- не обсуждать пациента в его присутствии;
- не смеяться над ним;
- снизить ожидания;
- говорить проще, задавать один вопрос за раз;
- не воспитывать — пациента с деменцией невозможно научить .
Любые физические упражнения замедляют снижение когнитивных функций и рекомендованы всем пациентам с ЛВД, которые могут безопасно их выполнять . При нарушениях речи могут помочь занятия с логопедом .
Прогноз. Профилактика
Пока не существует утверждённых методов лечения ЛВД, но в настоящее время проводятся активные клинические испытания, направленные на изучение конкретных механизмов развития ЛВД. В России специалисты по этому заболеванию работают в Научном центре неврологии.
Прогноз зависит от генетической мутации, которая привела к развитию заболевания. Например, носители мутации в гене MAPT живут с ЛВД от 3 до 10 лет . У носителей мутации в гене R406W продолжительность жизни гораздо больше — есть данные о том, что пациенты доживают до 70 лет .
При мутациях в гене GRN болезнь, как правило, дебютирует позже, чем у пациентов с мутациями в гене MAPT. У большинства больных симптомы развиваются после 50 лет, продолжительность жизни после начала болезни составляет в среднем 5 лет (3–22 года) и меньше при более позднем дебюте .
Семантический вариант болезни, как правило, прогрессирует медленнее, и пациенты могут жить 10 или более лет после появления симптомов .
По ЛВД, которая возникла по неизвестной причине, точной статистики нет: неизвестная причина — это, скорее всего, более редкие мутации, которые пока ещё не выявлены.
Предупредить развитие ЛВД нельзя, но можно обнаружить его как можно раньше. Это поможет родственникам пациента максимально комфортно организовать свою и его жизнь. Поэтому если вы заметили у себя или вашего близкого снижение памяти и/или внимания, то лучше как можно раньше обратиться к врачу — у таких симптомов могут быть и обратимые причины. Если у пожилого родственника изменилось поведение или появились проблемы с речью, то не стоит списывать эти изменения на возраст и нужно тоже проконсультироваться с доктором. Особенно настороженным нужно быть тем людям, у чьих родственников уже встречались такие симптомы.
Список литературы
- Ratnavalli E., Brayne C., Dawson K. et al. The prevalence of frontotemporal dementia // Neurology. — 2002. — № 11. — Р. 1615–1621.ссылка
- Coyle-Gilchrist I. T., Dick K. M., Patterson K. et al. Prevalence, characteristics, and survival of frontotemporal lobar degeneration syndromes // Neurology. — 2016. — № 18. — Р. 1736–1743.ссылка
- Knopman D. S., Roberts R. O. Estimating the number of persons with frontotemporal lobar degeneration in the US population // J Mol Neurosci. — 2011. — № 3. — Р. 330–335.ссылка
- Snowden J. S., Neary D., Mann D. M. Frontotemporal dementia // Br J Psychiatry. — 2002. — Vol. 180. — P. 140–143.ссылка
- Hogan D. B., Jette N., Fiest K. M. et al. The Prevalence and Incidence of Frontotemporal Dementia: a Systematic Review // Can J Neurol Sci. — 2016. — Vol. 43. — P. S96–S109. ссылка
- Onyike C. U., Diehl-Schmid J. The epidemiology of frontotemporal dementia // Int Rev Psychiatry. — 2013. — № 2. — P. 130–137. ссылка
- Lanata S. C., Miller B. L. The behavioural variant frontotemporal dementia (bvFTD) syndrome in psychiatry // J Neurol Neurosurg Psychiatry. — 2016. — № 5. — Р. 501–511. ссылка
- Mackenzie I. R., Neumann M., Bigio E. H. et al. Nomenclature for neuropathologic subtypes of frontotemporal lobar degeneration: consensus recommendations // Acta Neuropathol. — 2009. — № 1. — Р. 15–18.ссылка
- Chow T. W., Miller B. L., Hayashi V. N., Geschwind D. H. Inheritance of frontotemporal dementia // Arch Neurol. — 1999. — № 7. — Р. 817–822.ссылка
- Goldman J. S., Farmer J. M., Wood E. M. et al. Comparison of family histories in FTLD subtypes and related tauopathies // Neurology. — 2005. — № 11. — Р. 1817–1819.ссылка
- Rohrer J. D., Warren J. D. Phenotypic signatures of genetic frontotemporal dementia // Curr Opin Neurol. — 2011. — № 6. — Р. 542–549.ссылка
- Seelaar H., Rohrer J. D., Pijnenburg Y. A. L. et al. Clinical, genetic and pathological heterogeneity of frontotemporal dementia: a review // J Neurol Neurosurg Psychiatry. — 2011. — № 5. — Р. 476–486.ссылка
- Pickering-Brown S. M., Rollinson S., Du Plessis D. et al. Frequency and clinical characteristics of progranulin mutation carriers in the Manchester frontotemporal lobar degeneration cohort: сomparison with patients with MAPT and no known mutations // Brain. — 2008. — № 3. — Р. 721–731.ссылка
- Brun A. Frontal lobe degeneration of non-Alzheimer type I. Neuropathology // Arch Gerontol Geriatr. — 1987. — № 3. — Р. 193–208.ссылка
- Kril J. J., Halliday G. M. Pathological staging of frontotemporal lobar degeneration // J Mol Neurosci. — 2011. — № 3. — Р. 379–383.ссылка
- Khlistunova I., Biernat J., Wang Y. et al. Inducible expression of tau repeat domain in cell models of tauopathy: aggregation is toxic to cells but can be reversed by inhibitor drugs // J Biol Chem. — 2006. — № 2. — Р. 1205–1214.ссылка
- Hodges J. R., Patterson K. Semantic dementia: a unique clinicopathological syndrome // Lancet Neurol. — 2007. — № 11. — Р. 1004–1014.ссылка
- Rascovsky K., Hodges J. R., Knopman D. et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia // Brain. — 2011. — Vol. 134. — P. 2456–2477. ссылка
- Woolley J. D., Khan B. K., Murthy N. K. et al. The diagnostic challenge of psychiatric symptoms in neurodegenerative disease: rates of and risk factors for prior psychiatric diagnosis in patients with early neurodegenerative disease // J Clin Psychiatry. — 2011. — № 2. — Р. 126–133. ссылка
- Rosen H. J., Allison S. C., Schauer G. F. et al. Neuroanatomical correlates of behavioral disorders in dementia // Brain. — 2005. — Vol. 128. — P. 2612–2625.ссылка
- Seeley W. W. Selective functional, regional, and neuronal vulnerability in frontotemporal dementia // Curr Opin Neurol. — 2008. — № 6. — Р. 701–707.ссылка
- Tekin S., Cummings J. L. Frontal-subcortical neuronal circuits and clinical neuropsychiatry: an update // J Psychosom Res. — 2002. — № 2. — Р. 647–654.ссылка
- Tranel D., Bechara A., Denburg N. L. Asymmetric functional roles of right and left ventromedial prefrontal cortices in social conduct, decision-making, and emotional processing // Cortex. — 2002. — № 4. — Р. 589–612.ссылка
- Diehl-Schmid J., Perneczky R., Koch J. et al. Guilty by suspicion? Criminal behavior in frontotemporal lobar degeneration // Cogn Behav Neurol. — 2013. — № 2. — Р. 73–77. ссылка
- Liljegren M., Naasan G., Temlett J. et al. Criminal behavior in frontotemporal dementia and Alzheimer disease // JAMA Neurol. — 2015. — № 3. — Р. 295–300.ссылка
- Rankin K. P., Baldwin E., Pace-Savitsky C. et al. Self awareness and personality change in dementia // J Neurol Neurosurg Psychiatry. — 2005. — № 5. — Р. 632–639.ссылка
- Chow T. W., Binns M. A., Cummings J. L. et al. Apathy symptom profile and behavioral associations in frontotemporal dementia vs dementia of Alzheimer type // Arch Neurol. — 2009. — № 7. — Р. 888–893. ссылка
- Merrilees J., Hubbard E., Mastick J. et al. Rest-activity and behavioral disruption in a patient with frontotemporal dementia // Neurocase. — 2009. — № 6. — Р. 515–526. ссылка
- Mendez M. F., Shapira J. S. Loss of emotional insight in behavioral variant frontotemporal dementia or «frontal anosodiaphoria» // Conscious Cogn. — 2011. — № 4. — Р. 1690–1696. ссылка
- Ames D., Cummings J. L., Wirshing W. C. et al. Repetitive and compulsive behavior in frontal lobe degenerations // Journal of Neuropsychiatry and Clinical Neurosciences. — 1994. — № 2. — Р. 100–113.ссылка
- Josephs K. A., Whitwell J. L., Jack C. Jr. Anatomic correlates of stereotypies in frontotemporal lobar degeneration // Neurobiol Aging. — 2008. — № 12. — Р. 1859–1863. ссылка
- Miller B. L., Darby A. L., Swartz J. R. et al. Dietary changes, compulsions and sexual behavior in frontotemporal degeneration // Dementia. — 1995. — № 4. — Р. 195–199.ссылка
- Woolley J. D., Gorno-Tempini M. L., Seeley W. W. et al. Binge eating is associated with right orbitofrontal-insular-striatal atrophy in frontotemporal dementia // Neurology. — 2007. — № 14. — Р. 1424–1433.ссылка
- Gorno-Tempini M. L., Hillis A. E., Weintraub S. et al. Classification of primary progressive aphasia and its variants // Neurology. — 2011. — № 11. — Р. 1006–1014.ссылка
- Seeley W. W., Bauer A. M., Miller B. L. et al. The natural history of temporal variant frontotemporal dementia // Neurology. — 2005. — № 8. — Р. 1384–1390. ссылка
- Flanagan E. P., Baker M. C., Perkerson R. B. et al. Dominant frontotemporal dementia mutations in 140 cases of primary progressive aphasia and speech apraxia // Dement Geriatr Cogn Disord. — 2015. — № 5–6. — Р. 281–286.ссылка
- Hodges J. R., Patterson K., Ward R. et al. The differentiation of semantic dementia and frontal lobe dementia (temporal and frontal variants of frontotemporal dementia) from early Alzheimer’s disease: a comparative neuropsychological study // Neuropsychology. — 1999. — № 1. — Р. 31–40.ссылка
- Khan I., De Jesus O. Frontotemporal Lobe Dementia // StatPearls Publishing. — 2023.ссылка
- Rosen H. J., Gorno-Tempini M. L., Goldman W. P. Patterns of brain atrophy in frontotemporal dementia and semantic dementia // Neurology. — 2002. — № 2. — Р. 198–208.ссылка
- Miller B. L., Boone K., Cummings J. L. et al. Functional correlates of musical and visual ability in frontotemporal dementia // Br J Psychiatry. — 2000. — Vol. 176. — P. 458–463.ссылка
- Ogar J., Willock S., Baldo J. et al. Clinical and anatomical correlates of apraxia of speech // Brain Lang. — 2006. — № 3. — Р. 343–350. ссылка
- Gorno-Tempini M. L., Ogar J. M., Brambati S. M. Anatomical correlates of early mutism in progressive nonfluent aphasia // Neurology. — 2006. — № 10. — Р. 1849–1851. ссылка
- Perry R. J., Graham A., Williams G. et al. Patterns of frontal lobe atrophy in frontotemporal dementia: a volumetric MRI study // Dement Geriatr Cogn Disord. — 2006. — № 4. — Р. 278–287.ссылка
- Perry D. C., Brown J. A., Possin K. L. et al. Clinicopathological correlations in behavioural variant frontotemporal dementia // Brain. — 2017. — № 12. — Р. 3329–3345.ссылка
- Lee S. E., Khazenzon A. M., Trujillo A. J. et al. Altered network connectivity in frontotemporal dementia with C9orf72 hexanucleotide repeat expansion // Brain. — 2014. — Vol. 137. — P. 3047–3060. ссылка
- Tsai R. M., Bejanin A., Lesman-Segev O. et al. 18F-flortaucipir (AV-1451) tau PET in frontotemporal dementia syndromes // Alzheimers Res Ther. — 2019. — № 1. — Р. 1–18.ссылка
- Lomen-Hoerth C. Clinical phenomenology and neuroimaging correlates in ALS-FTD // J Mol Neurosci. — 2011. — № 3. — Р. 656–662. ссылка
- Geevasinga N., Loy C. T., Menon P. et al. Awaji criteria improves the diagnostic sensitivity in amyotrophic lateral sclerosis: a systematic review using individual patient data // Clin Neurophysiol. — 2016. — № 7. — Р. 2684–2691. ссылка
- Armstrong M. J., Litvan I., Lang A. E. et al. Criteria for the diagnosis of corticobasal degeneration // Neurology. — 2013. — № 5. — Р. 496–503. ссылка
- Hassan A., Whitwell J. L., Boeve B. F. et al. Symmetric corticobasal degeneration (S-CBD) // Parkinsonism Relat Disord. — 2010. — № 3. — Р. 208–214. ссылка
- Lee S. E., Rabinovici G. D., Mayo M. C. et al. Clinicopathological correlations in corticobasal degeneration // Ann Neurol. — 2011. — № 2. — Р. 327–340.ссылка
- Kertesz A., McMonagle P., Blair M. et al. The evolution and pathology of frontotemporal dementia // Brain. — 2005. — Vol. 128. — P. 1996–2005.ссылка
- Donker Kaat L., Boon A. J., Kamphorst W. et al. Frontal presentation in progressive supranuclear palsy // Neurology. — 2007. — № 8. — Р. 723–729.ссылка
- Kimura T., Takamatsu J. Pilot study of pharmacological treatment for frontotemporal dementia: risk of donepezil treatment for behavioral and psychological symptoms // Geriatr Gerontol Int. — 2013. — № 2. — Р. 506–507. ссылка
- Boxer A. L., Knopman D. S., Kaufer D. I. et al. Memantine in patients with frontotemporal lobar degeneration: a multicentre, randomised, double-blind, placebo-controlled trial // Lancet neurology. — 2013. — № 2. — Р. 149–156.ссылка
- Herrmann N., Black S. E., Chow T. et al. Serotonergic function and treatment of behavioral and psychological symptoms of frontotemporal dementia // Am J Geriatr Psychiatry. — 2012. — № 9. — Р. 789–797. ссылка
- Lebert F., Stekke W., Hasenbroekx C., Pasquier F. Frontotemporal dementia: a randomised, controlled trial with trazodone // Dement Geriatr Cogn Disord. — 2004. — № 4. — Р. 355–359. ссылка
- Pijnenburg Y. A., Sampson E. L., Harvey R. J. et al. Vulnerability to neuroleptic side effects in frontotemporal lobar degeneration // Int J Geriatr Psychiatry. — 2003. — № 1. — Р. 67–72. ссылка
- Chow T. W., Mendez M. F. Goals in symptomatic pharmacologic management of frontotemporal lobar degeneration // Am J Alzheimers Dis Other Demen. — 2002. — № 5. — Р. 267–272.ссылка
- Finger E. C. New potential therapeutic approaches in frontotemporal dementia: oxytocin, vasopressin, and social cognition // J Mol Neurosci. — 2011. — № 3. — Р. 696–701. ссылка
- Merrilees J. A model for management of behavioral symptoms in frontotemporal lobar degeneration // Alzheimer Dis Assoc Disord. — 2007. — № 4. — Р. S64–69. ссылка
- Cheng S. T., Chow P. K., Song Y. Q. et al. Mental and physical activities delay cognitive decline in older persons with dementia // Am J Geriatr Psychiatry. — 2014. — № 1. — Р. 63–74. ссылка
- Kortte K. B., Rogalski E. J. Behavioural interventions for enhancing life participation in behavioural variant frontotemporal dementia and primary progressive aphasia // Int Rev Psychiatry. — 2013. — № 2. — Р. 237–245. ссылка
- Boeve B. F., Hutton M. Refining frontotemporal dementia with parkinsonism linked to chromosome 17: introducing FTDP-17 (MAPT) and FTDP-17 (PGRN) // Arch Neurol. — 2008. — № 4. — Р. 460–464.ссылка
- Van Swieten J., Stevens M., Rosso S. et al. Phenotypic variation in hereditary frontotemporal dementia with tau mutations // Ann Neurol. — 1999. — № 4. — P. 617–626.ссылка
- Van Swieten J. C., Heutink P. Mutations in progranulin (GRN) within the spectrum of clinical and pathological phenotypes of frontotemporal dementia // Lancet Neurol. — 2008. — № 10. — Р. 965–974.ссылка
- Hodges J. R., Mitchell J., Dawson K. et al. Semantic dementia: demography, familial factors and survival in a consecutive series of 100 cases // Brain. — 2010. — Vol. 133. — P. 300–306. ссылка
- What Are Frontotemporal Disorders? Causes, Symptoms, and Treatment // National Institute on Aging. — 2021. — № 1.ссылка
- A Statement from the Willis Family // The Association for Frontotemporal Degeneration. — 2023.
- Taylor R., Finger E. Careful clinical, neuropsychologic, and imaging investigations make differential diagnosis of variants possible // Practical Neurology. — 2019.
- Российская ассоциация геронтологов и гериатров. Когнитивные расстройства у лиц пожилого и старческого возраста: клинические рекомендации. — М., 2020. — 317 с.